
| A. | N2、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| B. | 向AlCl3溶液中滴加过量的氨水能看到先产生白色沉淀,后沉淀溶解 | |
| C. | 可用浓硫酸或者浓硝酸除去镀在铝表面的铜镀层 | |
| D. | 在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉就会溶解 |
分析 A.NO不稳定,极易被氧气氧化生成NO2,氮气是空气主要成分;
B.Al(OH)3能溶于强碱溶液但不溶于弱碱溶液;
C.常温下Cu和浓硫酸不反应;
D.酸性条件下,硝酸根离子具有强氧化性,能氧化较不活泼金属如Cu等.
解答 解:A.氮气时空气的主要成分之一,不属于污染气体,且NO不稳定,极易被氧气氧化生成NO2
,反应方程式为2NO+O2=2NO2,故A错误;
B.氯化铝与氨水反应生成氢氧化铝沉淀,反应方程式为AlCl3+3NH3.H2O=Al(OH)3↓+3NH4Cl,Al(OH)3能溶于强碱溶液但不溶于弱碱溶液,氨水属于弱碱,所以氢氧化铝不溶于氨水,故B错误;
C.浓硫酸与铜需在加热条件下才能反应,所以不能用浓硫酸除去Cu,故C错误;
D.Cu与稀硫酸不反应,加入硝酸钾后,溶液中存在硝酸根离子、氢离子,则Cu与硝酸可发生反应,所以铜粉溶解,故D正确;
故选D.
点评 本题考查浓硫酸、硝酸、氢氧化铝、NO等物质性质,为高频考点,明确物质之间的反应是解本题关键,注意氢氧化铝能溶于强碱但不溶于强碱,易错选项是D.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
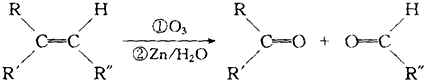
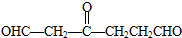 ,则该烯烃的结构不可能是( )
,则该烯烃的结构不可能是( )| A. | 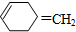 | B. | 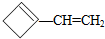 | C. | 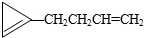 | D. | 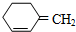 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

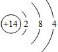 .D燃烧放出大量热量,有望成为二十一世纪的新能源,与“传统能源”相比,它具有便于储运,比较安全(写出两点)等更加优越的特点.
.D燃烧放出大量热量,有望成为二十一世纪的新能源,与“传统能源”相比,它具有便于储运,比较安全(写出两点)等更加优越的特点.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com