
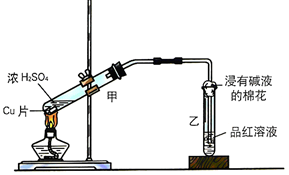
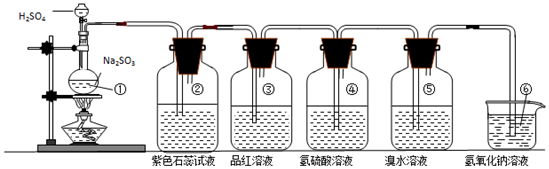
| 装置序号 | 实验现象或作用 | 实验结论或化学方程式 |
| ① | 有气泡产生 | 化学方程式为:Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑ |
| ② | 紫色石蕊试液变红色 | 证明SO2溶于水显酸性 |
| ③ | 品红溶液褪色 | 证明SO2具有漂白性 |
| ④ | 溶液变浑浊 | 证明SO2具有氧化性 |
| ⑤ | 溴水褪色 | 证明SO2具有还原性 |
| ⑥ | 吸收尾气 | 证明SO2属于酸性氧化物 |
分析 (1)①铜与浓硫酸反应生成硫酸铜和二氧化硫气体;
②评价实验方案要从反应的可操作性,生成物的性质,环保节能等方面分析.由于浓硫酸与铜直接反应时会生成有毒的二氧化硫,且需要的硫酸量较大所以一般不采用这种方式进行;
(2)①亚硫酸钠与浓硫酸反应生成二氧化硫、硫酸钠和水;
②二氧化硫溶于水和水反应生成亚硫酸,亚硫酸为弱酸;酸可以使紫色石蕊试液变红;
③二氧化硫与品红化合生成无色物质,能使品红溶液褪色;
④SO2中+4价S具有氧化性,硫化氢中-2价S具有还原性,二氧化硫能把硫化氢氧化成单质硫,本身被还原成单质硫;
⑤二氧化硫具有还原性,能够被溴水氧化;
⑥二氧化硫有毒,不能直接排放到空气中,为酸性氧化物能够与氢氧化钠反应生成亚硫酸钠和水.
解答 解:(1)①铜与浓硫酸反应生成硫酸铜和二氧化硫气体,反应的化学方程式为:Cu+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,故答案为:Cu+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
②甲方案生成二氧化硫,二氧化硫是一种有毒气体,所以甲方案不可取,通过计算可知生成相同质量的硫酸铜,乙方案消耗的硫酸少,既节约了原料,又不污染环境.
故答案为:乙;甲有二氧化硫产生,污染空气,乙无污染,硫酸利用率高;
(2)①中为亚硫酸钠和浓硫酸反应生成二氧化硫气体,反应的化学方程式为:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O,
故答案为:Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑;
②氧化硫溶于水和水反应生成亚硫酸,亚硫酸为弱酸,可以使紫色石蕊试液变红,
故答案为:红色;
③二氧化硫与品红化合生成无色物质,能使品红溶液褪色,故二氧化硫具有漂白性,
故答案为:漂白性;
④SO2中+4价S具有氧化性,硫化氢中-2价S具有还原性,二氧化硫能把硫化氢氧化成单质硫,本身被还原成单质硫,反应方程式为SO2+2H2S=3S↓+2H20,
故答案为:氧化;
⑤二氧化硫具有还原性,能够与溴水发生氧化还原反应生成氢溴酸和硫酸,溴水褪色,
故答案为:还原;
⑥二氧化硫有毒,不能直接排放到空气中,二氧化硫酸性氧化物能够与氢氧化钠反应生成亚硫酸钠和水,故答案为:酸.
点评 本题考查了SO2的性质的实验设计和性质分析判断,掌握二氧化硫酸性氧化物性质、漂白性、氧化性和还原性等是解题关键,题目难度中等.


科目:高中化学 来源: 题型:实验题
 ,
,
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体是一种分散系,属于混合物 | |
| B. | 胶体的本质特征是能发生丁达尔现象 | |
| C. | 胶体粒子直径介于1nm-100nm | |
| D. | 利用丁达尔现象是区分胶体和溶液的一种常用方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称取3.55g硫酸钠,加入250mL水 | |
| B. | 称取2.84g硫酸钠,加水配成250mL溶液 | |
| C. | 称取6.44g硫酸钠晶体(Na2SO4•10H2O)配成250mL溶液 | |
| D. | 称取8.05g硫酸钠晶体(Na2SO4•10H2O)配成250mL溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若Ⅰ达平衡时,A、B、C各增加1mol,则C转化率将一定增大 | |
| B. | 若向Ⅰ平衡体系中在加入1molA和3molB,C的体积分数若大于x,可断定n>3 | |
| C. | 若Ⅱ体系起始物质的量满足9a+c=3b,则可判断n=3 | |
| D. | 若n=2,则Ⅱ体系起始物质的量应满足2a+1<b<3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11:2 | B. | 9:1 | C. | 9:4 | D. | 5:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100ml0.1mol•L-1Na2SO4溶液中,微粒总数是0.03NA | |
| B. | 标准状况下,分子数为NA的N2、C2H4混合气体的质量无法确定 | |
| C. | 常温常压下,32g O2-中所含电子的数目为17NA | |
| D. | 标准状况下,11.2L酒精含有的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com