
| A. | $\frac{{c(O{H^-})}}{{c(N{H_3}•{H_2}O)}}$ | B. | $\frac{{c(N{H_3}•{H_2}O)}}{{c(O{H^-})}}$ | ||
| C. | c(H+)和c(OH--)的乘积 | D. | OH-的物质的量 |
分析 用水稀释0.1mol/L氨水时,溶液中随着水量的增加,由NH3.H2O?OH-+NH4+可知,n(OH-)增大,但溶液的体积增大的多,则c(OH-)减小,加水促进电离,则n(NH3.H2O)减少.
解答 解:A、由NH3.H2O?OH-+NH4+可知,加水促进电离,则n(NH3.H2O)减少,n(OH-)增大,$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大,故A错误;
B、由NH3.H2O?OH-+NH4+可知,加水促进电离,则n(NH3.H2O)减少,n(OH-)增大,$\frac{c(N{H}_{3}•{H}_{2}O)}{c(O{H}^{-})}$减小,故B正确;
C、因加水稀释时,温度不变,则c(H+)和c(OH-)的乘积不变,故C错误;
D、由NH3.H2O?OH-+NH4+可知,加水促进电离,OH-的物质的量增大,故D错误;
故选B.
点评 本题考查弱电解质的电离,明确稀释时电离平衡的移动及离子的物质的量、离子的浓度的变化是解答的关键,并注意离子积与温度的关系来解答.


 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:选择题
| A. | V(NaOH)=0时,c(H+)=1×10-2 mol/L | |
| B. | V(NaOH)<10 mL时,可能存在c(Na+)=2c(C2O42-)+c(HC2O4-) | |
| C. | V(NaOH)=10mL时,c(H+)=1×10-7 mol/L | |
| D. | V(NaOH)>10 mL时,c(Na+)>c(HC2O4-)>c(C2O42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | R的氧化物都能溶于水 | |
| B. | R的最高价氧化物对应的水化物都是H2RO3 | |
| C. | R是非金属元素 | |
| D. | R的氧化物都能与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素W 的简单气态氢化物的热稳定性比X 的强 | |
| B. | 元素W 的最高价氧化物对应水化物的酸性比Z 的弱 | |
| C. | 化合物YX、ZX2、WX3 中化学键的类型相同 | |
| D. | 原子半径的大小顺序:rY>rZ>rW>rX |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 煤、天然气、石油综合利用是构建节约型、环境友好型社会的必然选择.
煤、天然气、石油综合利用是构建节约型、环境友好型社会的必然选择. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{53}^{127}$I、${\;}_{53}^{131}$I、${\;}_{55}^{134}$Cs、${\;}_{55}^{137}$Cs是四种核素,两组同位素 | |
| B. | ${\;}_{53}^{131}$I和${\;}_{55}^{137}$Cs的中子数分别是78、82 | |
| C. | 在周期表中Cs与I位于同一周期 | |
| D. | 铯与碘能化合生成CsI |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 一个完整的氧化还原反应的方程式可以拆开,写成两个“半反应式”,一个是氧化反应式,另一个是还原反应式.如2Fe3++Cu═2Fe2++Cu2+的拆写结果是:
一个完整的氧化还原反应的方程式可以拆开,写成两个“半反应式”,一个是氧化反应式,另一个是还原反应式.如2Fe3++Cu═2Fe2++Cu2+的拆写结果是:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、CS2、HI都是直线形分子 | B. | BF3键角为120°,NH3键角大于120° | ||
| C. | BF3、SO3都是平面三角形分子 | D. | PCl3、NH3、PCl5都是三角锥形分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
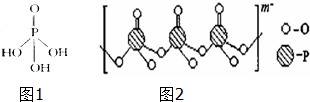 磷单质及其化合物在工业生产巾有着广泛的应用.向磷可用于制备高纯度的磷酸(磷酸结构简式如图1),三聚磷酸钠是常用的水处理剂,次磷酸钠(NaH2PO2)可用于化学镀镍等等.完成下列填空:
磷单质及其化合物在工业生产巾有着广泛的应用.向磷可用于制备高纯度的磷酸(磷酸结构简式如图1),三聚磷酸钠是常用的水处理剂,次磷酸钠(NaH2PO2)可用于化学镀镍等等.完成下列填空:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com