
将下图所示实验装置的K闭合,下列判断正确的是( )
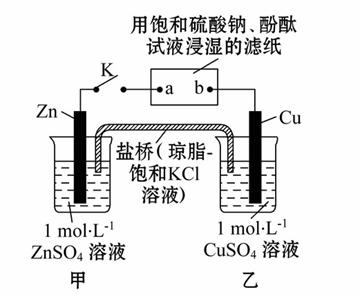
A.Cu电极上发生还原反应
B.电子沿Zn→a→b→Cu路径流动
C.片刻后甲池中c(SO42-)增大
D.片刻后可观察到滤纸b点变红色
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
从海带中提取碘的实验过程中,涉及到下列操作,其中正确的是
| | |||
| A.将海带灼烧成灰 | B.过滤得含I-溶液 | C.萃取后放出碘 的CCl4溶液 | D.分离碘并回收CCl4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:在卡片上,描述合理的是( )
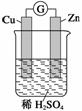

A.①②③ B.③④⑤ C.④⑤⑥ D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
我国卫星发射所用的长征2号火箭的主要燃料是偏二甲肼(C2H8N2),氧化剂是NO2,燃烧产物只有N2、CO2和H2O。有的国家用肼(N2H4)作为火箭发动机的燃料。NO2为氧化剂,反应生成N2和水蒸气。已知:
N2(g)+2O2(g)====2NO2(g) ΔH=+67.7 kJ·mol-1
N2H4(g)+O2(g)====N2(g)+2H2O(g) ΔH=-534 kJ·mol-1。
下列关于肼和NO2反应的热化学方程式中正确的是( )
A.2N2H4(g)+2NO2(g)====3N2(g)+4H2O (l) ΔH=+1 135.7 kJ·mol-1
B.2N2H4(g)+2NO2(g)====3N2(g)+4H2O(l) ΔH=-1 135.7 kJ·mol-1
C.N2H4(g)+NO2(g)====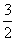 N2(g)+2H2O(g) ΔH=+1 135.7 kJ·mol-1
N2(g)+2H2O(g) ΔH=+1 135.7 kJ·mol-1
D.2N2H4(g)+2NO2(g)====3N2(g)+4H2O(g) ΔH=-1 135.7 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
铁镍蓄电池又称爱迪生电池,放电时的总反应为:
Fe+Ni2O3+3H2O Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是( )
Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是( )
A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe
B.电池放电时,负极反应为Fe+2OH--2e-====Fe(OH)2
C.电池充电过程中,阴极附近溶液的pH降低
D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-====Ni2O3+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
可燃冰中蕴藏着大量的甲烷,有望成为未来新能源。已知1 mol CH4气体完全燃烧生成CO2气体和液态H2O时放出的热量为890.3 kJ,当它不完全燃烧生成CO气体和液态H2O时,放出的热量为519 kJ。如果1 mol CH4在n g O2中燃烧生成CO、CO2气体和液态H2O,放出731.25 kJ热量。
(1)写出表示甲烷燃烧热的热化学方程式。
(2)写出甲烷气体不完全燃烧的热化学方程式。
(3)计算n的值。
查看答案和解析>>
科目:高中化学 来源: 题型:
高温下,某反应达到平衡,平衡常数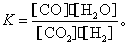 恒容时,温度升高,H2浓度减小。下列说法正确的是( )
恒容时,温度升高,H2浓度减小。下列说法正确的是( )
A.该反应的焓变为正值
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应化学方程式为 CO+H2O CO2+H2
CO2+H2
查看答案和解析>>
科目:高中化学 来源: 题型:
向足量的H2SO4溶液中加入100 mL 0.4 mol·L-1 Ba(OH)2溶液,放出的热量是5.12 kJ。向足量的Ba(OH)2溶液中加入100 mL 0.4 mol·L-1 HCl溶液时,放出的热量为2.292 kJ。下列有关反应的热化学方程式中正确的是( )
A.Ba2+(aq)+SO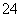 (aq)+2OH-(aq)+2H+(aq)===BaSO4(s)+2H2O(l) ΔH=+128 kJ·mol-1
(aq)+2OH-(aq)+2H+(aq)===BaSO4(s)+2H2O(l) ΔH=+128 kJ·mol-1
B.OH-(aq)+H+(aq)===H2O(l) ΔH=-64 kJ·mol-1
C.Ba2+(aq)+SO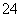 (aq)===BaSO4(s) ΔH=-57.3 kJ·mol-1
(aq)===BaSO4(s) ΔH=-57.3 kJ·mol-1
D.Ba2+(aq)+SO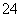 (aq)===BaSO4(s) ΔH=-13.4 kJ·mol-1
(aq)===BaSO4(s) ΔH=-13.4 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com