
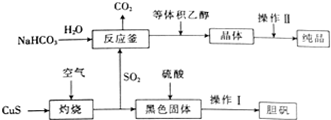
 硫及其化合物在生产及生活中有着广泛的应用.
硫及其化合物在生产及生活中有着广泛的应用.分析 (1)依据氧化还原反应规律:S8与氢氧化钠反应生成一种产物亚硫酸钾,硫元素化合价升高,则必有化合价降低产物,应为硫化钠,结合氧化还原反应得失电子守恒书写方程式;
(2)依据方程式:2H2S+O2(少量)$\frac{\underline{\;点燃\;}}{\;}$2S+2H2O,S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2,计算解答;
(3)由反应可知生成MnO4-,根据得失电子守恒得出正确结论;
(4)①Na2S2O5晶体在空气中被氧化生成Na2SO4;
②反应釜反应方程式为2NaHCO3+2SO2=Na2S2O5+2CO2+H2O
③反应后溶液中c(S2-)=0.01mol/L,再根据Ksp(CuS)=6.3×10-36进行计算c(Cu2+).
解答 解:(1)依据题意可知单质硫与氢氧化钠发生歧化反应生成硫化钠和亚硫酸钠和水,方程式:3S8+48NaOH=16Na2S+8Na2SO3,离子方程式:3S8+48OH-=24H2O+16S2-+8SO32-,故答案为:3S8+48OH-=24H2O+16S2-+8SO32-;
(2)标准状况下将2.24L H2S与2.24L O2 物质的量都是0.1mol,硫化氢与氧气反应先生成硫单质,硫单质再与氧气反应生成二氧化硫,则:
2H2S+O2(少量)$\frac{\underline{\;点燃\;}}{\;}$2S+2H2O,
2 1 2
0.1 0.05 0.1
S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2,
1 1 1
0.05 0.05 0.05
所以生成硫的物质的量为0.1mol-0.05mol=0.05mol;
反应后气体为二氧化硫,相对分子质量为64,反应前气体为硫化氢与氧气11混合,平均相对分子质量为$\frac{34+32}{2}$=33
依据相同条件下气体密度之比等于摩尔质量质量等于相对分子质量之比,则待温度恢复到原温度时,容器中气体密度是原来的$\frac{64}{33}$倍;
故答案为:0.05mol;$\frac{64}{33}$.
(3)由反应可知生成MnO4-,Mn元素化合价由+2价升高为+7价,共升高5价,O元素化合价由-1价降低为-2价,2个O共降低2价,故反应过程中转移5mol电子,则生成MnO4-的物质的量为$\frac{5}{5}$=1mol,
故答案为:1mol;
(4)①干燥时需要在还原性气候或惰性气体氛围下,其原因Na2S2O5晶体在空气中被氧化生成Na2SO4,
故答案为:Na2S2O5晶体在空气中被氧化生成Na2SO4;
②反应釜反应方程式为2NaHCO3+2SO2=Na2S2O5+2CO2+H2O,
故答案为:2NaHCO3+2SO2=Na2S2O5+2CO2+H2O;
③反应后溶液中c(S2-)=0.01mol/L,又知Ksp(CuS)=6.3×10-36,故c(Cu2+)=$\frac{6.3×1{0}^{-36}}{0.01}$=6.3×10-34
故答案为:6.3×10-34
点评 本题考查了离子方程式书写,有关方程式的计算,明确硫及其化合物性质,熟悉氧化还原反应得失电子守恒规律是解题关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
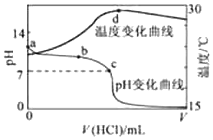 室温下,将1.000mol•L-1盐酸滴入20.00mL 1.000mol•L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )
室温下,将1.000mol•L-1盐酸滴入20.00mL 1.000mol•L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )| A. | a点由水电离出的c(H+)=1.0×10-14mol/L | |
| B. | b点:c(NH4+)+c(NH3•H2O)>c(Cl-) | |
| C. | b点时加入的盐酸体积小于20.00mL,而c点时加入的盐酸体积大于20.00mL | |
| D. | d点后,溶液温度略下降的主要原因是NH3•H2O电离吸热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验后剩余的钠粒,需要放回原试剂瓶中 | |
| B. | 自然界中钠只能以化合物的形式存在 | |
| C. | 钠的化学性质比较活泼,少量的钠可以保存在与钠不反应的煤油中 | |
| D. | 当钠与硫酸铜溶液反应时,有大量红色固体铜出现 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 甲 | 乙 | 丙 | 丁 | ||
| 密闭容器体积/L | 2 | 2 | 2 | 1 | |
| 起始物质的量 | n(SO2)/mol | 0.4 | 0.8 | 0.8 | 0.4 |
| n(O2)/mol | 0.24 | 0.24 | 0.48 | 0.24 | |
| SO2的平衡转化率/% | 80 | α1 | α2 | α3 | |
| A. | SO2的平衡转化率:α1>α2=α3 | B. | SO3的物质的量浓度:c(甲)=c(丁)<c(丙) | ||
| C. | 甲、乙中的平衡常数:K(甲)=K(乙)=400 | D. | 丙、丁中的平衡常数:K(丙)<K(丁) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知卤化银AgX的沉淀溶解平衡曲线如图所示,横坐标p(Ag+)=-lg(Ag+),纵坐标Y=-lg(X-),下列说法正确的是( )
已知卤化银AgX的沉淀溶解平衡曲线如图所示,横坐标p(Ag+)=-lg(Ag+),纵坐标Y=-lg(X-),下列说法正确的是( )| A. | 该温度下AgCl的Ksp约为1×10-15 | |
| B. | a点可表示AgCl的过饱和溶液 | |
| C. | b点时c(Ag+)=c(I-) | |
| D. | 该温度下,AgCl和AgBr饱和溶液中:c(Cl-)<c(Br-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| X(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| X(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②④ | C. | ②③ | D. | ①②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com