
| A. | 25% | B. | 28.6% | C. | 15% | D. | 20% |
分析 发生 N2+3H2?2NH3,达到平衡时,H2的转化率为50%,转化的氢气为2mol×50%=1mol,则
N2+3H2?2NH3
开始 2 4 0
转化 1 3 2
平衡 1 1 2
以此计算平衡时的氮气的体积分数.
解答 解:发生 N2+3H2?2NH3,达到平衡时,H2的转化率为50%,转化的氢气为2mol×50%=1mol,则
N2+3H2?2NH3
开始 2 4 0
转化 1 3 2
平衡 1 1 2
平衡时的氮气的体积分数接近于$\frac{1mol}{1mol+1mol+2mol}$×100%=25%,
故选A.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、转化率计算等为解答的关键,侧重分析与计算能力的考查,注意体积分数等于物质的量分数,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 用X表示此反应的反应速率是0.1amol•L-1•min-1 | |
| B. | 当混合气体的压强不再发生变化时,说明反应达到平衡状态 | |
| C. | 向平衡后的体系中加入1 mol M,平衡向逆反应方向移动 | |
| D. | 向上述平衡体系中再充入1 mol X,v正增大,v逆减小,平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
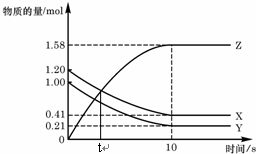 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图,下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图,下列描述正确的是( )| A. | t秒时该反应达到化学平衡状态 | |
| B. | 反应开始到10 s,X的物质的量浓度减少了0.79mol/L | |
| C. | 反应开始到10s时,Y的转化率为79.0% | |
| D. | 反应的化学方程式为:X(g)+Y(g)?2Z(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a+b}{5×100%}$ | B. | $\frac{2(a+b)}{5b×100%}$ | C. | $\frac{200(a+b)}{5b}$% | D. | $\frac{(a+b)}{5a×100%}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | E2F2 | B. | E2F3 | C. | EF3 | D. | EF2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
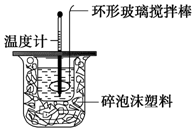 某实验小组用0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.
某实验小组用0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 | 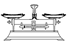 |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
| 温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
| H2S O4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入苯酚显紫色的溶液:K+、NH4+、Cl-、I-;加入酚酞呈红色的溶液:SO42-、K+、Cl-、HSO3-分别都不能大量共存(常温下) | |
| B. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液:K+、AlO2-、CO32-、Na+; pH=2的溶液:NO3-、Fe2+、Na+、Al3+分别都可以大量共存(常温下) | |
| C. | 已知:25℃时,Mg(OH)2的Ksp=5.61×10-12,MgF2的KSP=7.42×10-11,25℃时,在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2 可以转化为MgF2 | |
| D. | 表示H2燃烧热的化学方程式为:H2(g)+$\frac{1}{2}$O2(g)═H2O(1);△H=-285.8kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com