

| B中棉花的位置 | ① | ② | ③ | ④ |
| 所蘸试剂 | 石蕊试液 | 品红溶液 | 淀粉和碘水混合液 | 氢硫酸 |
| 现象 | 变红 变红 |
褪色 褪色 |
褪色 | 浅黄色 |
| 体现SO2的性质 | 水溶液显酸性 | 漂白性 | 还原性 还原性 |
氧化性 氧化性 |
| B中棉花位置 | ① | ② | ③ | ④ |
| 所蘸试剂 | ||||
| 现象 | 变红 | 褪色 | ||
| 体现的性质 | 还原性 | 氧化性 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2013-2014学年福建省厦门市高三质量检查(第一次)理综化学试卷(解析版) 题型:实验题
亚硝酸钠(NaNO2)是一种外观与食盐相似的食品添加剂。某化学兴趣小组进行如下实验。
【实验I】
用如下装置(已省略夹持装置)制NaNO2。
已知:2NO+Na2O2=2NaNO2;2NO2+Na2O2=2NaNO3。

(1)仪器甲的名称是________.装置B的作用是_________________________。
(2)装置D可将剩余的NO氧化成NO ,发生反应的离子方程式为_____________。
,发生反应的离子方程式为_____________。
(3)使用气密性良好的上述装置进行实验,NaNO2的纯度较低。为提高NaNO2纯度须对
上述实验装置或药品进行改进,其改进措施是________________________________。
【实验Ⅱ】
利用目视比色法(比较溶液颜色深浅以测定物质浓度)测定泡菜样品中NaNO2的含量。
步骤i:在5个有编号的试管中分别加入不同量的NaNO2溶液,各加入1 mL的M溶液 (M遇NaNO2呈紫红色,NaNO2浓度越大颜色越深),再加蒸馏水至总体积均为l0 mL并振荡,制成标准色阶。

步骤ⅲ:取5 mL待测液X,加入1 mLM溶液,加蒸馏水至10mL振荡,与标准色阶比较。
(4)步骤ii获取待测液X的过程中,加入明矾的目的是__________。
(5)步骤iii比较结果与④号色阶颜色相同,此泡菜样品中NaNO2的含量为_________mg·kg-1
(6)用目视比色法证明泡菜中加入维生素C可以降低NaNO2的含量。设计并完成下列实
验报告。

查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖南省“五市十校”高三12月联合检测化学试卷(解析版) 题型:填空题
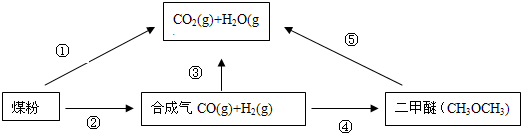
过度排放CO2会造成“温室效应”,为了减少煤燃烧对环境造成的污染,煤的气化是高效、清洁利用煤炭的重要途径。煤综合利用的一种途径如图所示。

(1)已知①C(s) + H2O(g) = CO(g)+H2(g) ΔH1=+131.3 kJ·mol-1
②C(s) + 2H2O(g) = CO2(g) + 2H2(g) ΔH2=+90 kJ·mol-1
则一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式是 ________________________,
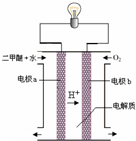
(2)用下图原电池装置可以完成过程⑤的转化,该装置b电极的电极反应式是_______________________。

(3)在压强为0.1 MPa条件下,容积为V L的密闭容器中a mol CO与2a mol H2在催化剂作用下反应生成甲醇:
CO(g)+2H2(g)  CH3OH(g),CO的平衡转化率与温度、压强的关系如下图所示,则:
CH3OH(g),CO的平衡转化率与温度、压强的关系如下图所示,则:
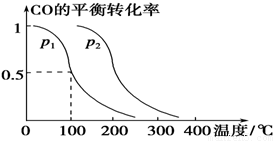
①p1________p2(填“>”、“<”或“=”)。
②在其他条件不变的情况下,向容器中再增加a mol CO与2a mol H2,达到新平衡时,CO的平衡转化率________(填“增大”、“减小”或“不变”)。
③在p1下,100 ℃时,CO(g)+2H2(g)
 CH3OH(g)反应的平衡常数为________(用含a、V的代数式表示)。
CH3OH(g)反应的平衡常数为________(用含a、V的代数式表示)。
(4)如图表示CO2与H2反应生成CH3OH和H2O的过程中能量(单位为kJ·mol-1)的变化:

关于该反应的下列说法中,正确的是________(填编号)。
A.ΔH>0,ΔS>0 B.ΔH>0,ΔS<0
C.ΔH<0,ΔS<0 D.ΔH<0,ΔS>0
(5)为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1 mol
CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化的曲线如图所示:
CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化的曲线如图所示:

①从反应开始到平衡,CO2的平均反应速率v(CO2)=________。
②下列措施中能使化学平衡向正反应方向移动的是________(填编号)。
A.升高温度 B.将CH3OH(g)及时液化移出
C.选择高效催化剂 D.再充入1 mol CO2和3 mol H2
查看答案和解析>>
科目:高中化学 来源:东城区二模 题型:问答题



查看答案和解析>>
科目:高中化学 来源:2011年北京市东城区高考化学二模试卷(解析版) 题型:解答题



查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com