
【题目】设NA为阿伏加德罗常数,下列说法不正确的是
A. 1mol O2与金属钠反应,O2不一定得到4NA个电子
B. 标准状况下,a L CH4和a L C6H14中所含分子数均为![]()
C. 常温常压下,1mol氯气与足量的金属镁反应,转移2NA个电子
D. 在20℃、1atm时,2.8g C2H4和CO的混合气体含气体分子数等于0.1 NA
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法错误的是
A. PM2.5是指粒径不大于2.5μm的可吸入悬浮颗粒物
B. 绿色化学要求从源头上消除或减少生产活动对环境的污染
C. 燃煤中加入CaO可以减少酸雨的形成及温室气体的排放
D. 天然气和液化石油气是我国目前推广使用的清洁燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2X为二元弱酸,常温下,将NaOH溶液加入到H2X溶液中,在不同pH环境下,不同形态的粒子(酸、酸式酸根、酸根离子)的组成分数如图所示。下列说法正确的是

A. HX-的电离程度小于水解程度
B. 在pH=7的溶液中HX-和X2-能大量共存
C. 在pH=9时,H2X 与NaOH恰好完全中和
D. 1L.0.1 molL-1Na2X溶液中,n(HX-)+2n(X2-)+n(H2X)=0.1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的混合气体,在密闭容器中发生如下反应:xA(g)+yB(g)![]() zC(g),达到平衡后测得A气体的浓度为0.5 mol·L-1,当恒温下将密闭容器的容积扩大到两倍再达到平衡后,测得A浓度为0.3 mol·L-1,则下列叙述正确的是
zC(g),达到平衡后测得A气体的浓度为0.5 mol·L-1,当恒温下将密闭容器的容积扩大到两倍再达到平衡后,测得A浓度为0.3 mol·L-1,则下列叙述正确的是
A. 平衡向正反应方向移动 B. x+y<z
C. C 的体积分数降低 D. B的转化率提高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下到有关电解质溶液的说法不正确的是( )
A. 向Na2CO3溶液中通入NH3, 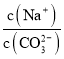 减小
减小
B. 将0.1mol·L-1的K2C2O4溶液从25℃升温至35℃,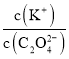 增大
增大
C. 向0.1mol·L-1的HF溶液中滴加NaOH溶液至中性, 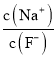 =1
=1
D. 向0.1mol·L-1的CH3COONa溶液中加入少量水, 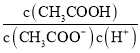 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在工农业生产和生命活动中起着重要的作用,铵盐、硝酸盐均是植物生长的“食物”,将氮气转化为氮气是植物获得“食物”的第一步,在常温常压下使N2高效地转化成为NH3是众多科学家们一直在探究的问题:
(1)已知:①4NH3(g)+5O2(g)4NO(g)+6H2O(g)△H=﹣1025kJmol﹣1
②N2(g)+O2(g)2NO(g)△H=+180.5kJmol﹣1水的汽化热△H=+44kJmol﹣1据报道,科学家已找到一种催化剂,使氨气与液态水在常温条件下转化为NH3及氧气,写出反应的热化学方程式____________________________________________________________;
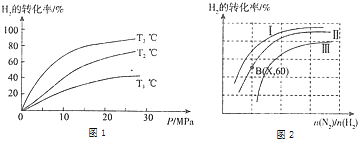
(2)工业时合成氨的原理为:N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJmol﹣1 。图1表示H2的转化率与温度、压强之间的关系,图2表示H2的转化率与起始投料比[n(N2)/n(H2)]、压强的变化关系,则T1、T2、T3的大小关系为___ , 曲线与曲线对应的压强P1___P2(填“>”“<”“=”).测得B(X,60)点时N2的转化率为40%,则X=______________________。
(3)一定温度下,将2molN2和6molH2置于一密闭容器中反应,测得平衡时容器的总压为aMPa,NH3的物质的量总数为20%,列式计算出此时的平衡常数Kp=___(用平衡分压代替平衡浓度进行计算,分压=总压×体积分数,可不化简)。
下列各项中能说明反应已达到平衡状态的是_____________________ 。
a.混合气体的平均相对分子质量不变
b.N2的消耗速率等于NH3的生成速率
c.混合气体的密度不变
d.N2和H2的物质的量之比保持不变
(4)NH3催化剂生成NO,以NO为原料通过电解的方法可以制备NH4NO3 , 其总反应是8NO+7H2═3NH4NO3+2HNO3 , 试写出以惰性材料作电极的阴极反应式:___ . 电解过程中为使电解产物全部转化为NH4NO3 , 需要补充NH3的原因是___ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图中的实验,能达到实验目的的是( )
A.  证明稳定性:Na2CO3>NaHCO3
证明稳定性:Na2CO3>NaHCO3
B.  证明非金属性:Cl>Br>I
证明非金属性:Cl>Br>I
C.  验证镁和盐酸反应的热效应
验证镁和盐酸反应的热效应
D. 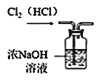 除去 Cl2 中的杂质气体 HCl
除去 Cl2 中的杂质气体 HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学进行如下实验,以检验化学反应中的能量变化。
(1)实验中发现,反应后①中的温度升高;②中的温度降低.由此判断铝条与盐酸的反应是______热反应, Ba(OH)28H2O与NH4Cl反应时,需要将固体研细其目的是________________.反应过程______ (填“①”或“②”)的能量变化可用图表示。

(2)为了验证Fe3+与Cu2+氧化性强弱,下列装置能达到实验目的是_________(填序号)。

(3)将CH4设计成燃料电池,其利用率更高,装置如图所示(a、b为多孔碳棒)其中____(填A或B)处电极入口通甲烷,其电极反应式为_____________________ 。当消耗标况下甲烷33.6L时,假设能量转化率为90%,则导线中转移电子的物质的量为_________mol。

(4)如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:

①当电极c为Al、电极d为Cu、电解质溶液为稀硫酸时,写出该原电池正极的电极反应式为_______________。
②当电极c为Al、电极d为Mg、电解质溶液为氢氧化钠溶液时,该原电池的正极为_______;该原电池的负极反应式为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中“实验内容”与对应“现象或结论”关系都正确的是
选项 | 实验内容 | 实验现象或结论 |
A | 分别往4 mL 0.1 mol/L 、4 mL 0.2 mol/L KMnO4溶液加入2 mL 0.1 mol/L H2C2O4溶液,记录褪色时间 | 浓度越大,反应速率越快越先褪色 |
B | 25℃时,向pH=1的盐酸和醋酸各0.5L的溶液中各加入1.4g铁粉 | 醋酸中生成H2的速率快且最终气体量多 |
C | 以石墨为电极,电解KI溶液(其中含有少量酚酞) | 阴极逸出气体且附近溶液呈现红色 |
D | 向FeCl3+3KSCN | 血红色变浅,说明增加生成物浓度,平衡逆向移动 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com