
| A. | 食盐 | B. | 烧碱 | C. | 漂白粉 | D. | 过氧化钠 |
分析 化合价发生变化的反应为氧化还原反应,因发生非氧化还原反应而变质,说明该物质中所含元素的化合价没有发生变化,以此解答该题.
解答 解:A.NaCl在空气中难以变质,更不发生氧化还原反应,故A错误;
B.烧碱为氢氧化钠,氢氧化钠易与空气中二氧化碳、水反应生成碳酸钠而变质,该反应不属于氧化还原反应,故B正确;
C.次氯酸钙与空气中二氧化碳反应生成次氯酸和碳酸钙,HClO见光分解生成HCl和氧气,发生氧化还原反应而变质,故C错误;
D.过氧化钠与水反应生成氢氧化钠和氧气,与二氧化碳反应生成碳酸钠和氧气,导致过氧化钠变质,两个反应都是氧化还原反应,故D错误;
故选B.
点评 本题考查氧化还原反应,侧重于基础知识的考查,明确物质的性质是解答该类题目的关键,注意掌握氧化还原反应的概念及特征,试题培养了学生的灵活应用能力.


 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:选择题
| A. | 甲烷中混有的乙烯,可以用酸性KMnO4溶液洗气除去 | |
| B. | 乙烯、苯都易燃烧,燃烧时都产生明亮火焰、大量黑烟 | |
| C. | 乙酸乙酯、油脂都能水解,且在热的NaOH溶液中水解更完全 | |
| D. | 葡萄糖、淀粉都有还原性,都能与新制Cu(OH)2共热产生砖红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
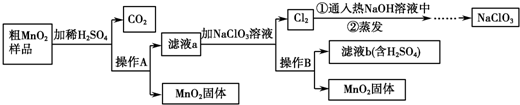
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝制电线电缆 | B. | 铝制餐具 | C. | 铝制可乐易拉罐 | D. | 糖果内包装 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水应该盛放在棕色的广口瓶中 | |
| B. | 某溶液中加入CCl4后显紫色,证明溶液中有I- | |
| C. | 能使湿润的淀粉碘化钾试纸变蓝的气体一定是氯气 | |
| D. | 某溶液中滴加BaCl2溶液后有白色沉淀生成,加入稀盐酸后沉淀不消失,则该溶液中可能有Ag+或SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠融化成银白色小球 | B. | 小球在液面上快速游动 | ||
| C. | 溶液底部出现银白色固体 | D. | 溶液变浑浊 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
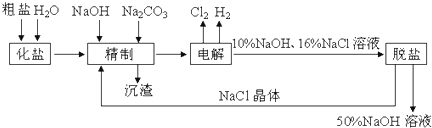
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com