
CuSO4溶液是中学化学及工农业生产中常见的一种试剂。
(1)某同学配制CuSO4溶液时,向盛有一定量硫酸铜晶体的烧杯中加入适量的蒸馏水,并不断搅拌,结果得到悬浊液。他认为是固体没有完全溶解,于是对悬浊液加热,结果发现浑浊更明显了,随后,他向烧杯中加入了一定量的 溶液,得到了澄清的CuSO4溶液。
(2)该同学利用制得的CuSO4溶液,进行以下实验探究。
①图一是根据反应Zn + CuSO4== Cu + ZnSO4设计成的锌铜原电池。Cu极的电极反应式是 ,盐桥中是含有琼胶的KCl饱和溶液,电池工作时K+向 移动(填“甲”或“乙”)。
②图二中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜,则b处通入的是 (填“CH4”或“O2”),a处电极上发生的电极反应式是 ;当铜电极的质量减轻3.2g,则消耗的CH4在标准状况下的体积为 L。
(3)反应一段时间后,燃料电池的电解质溶液完全转化为K2CO3溶液,以下关系正确的是 。
| A.c(K+)+c(H+)=c(HCO3-)+ c(CO32-)+c(OH-) |
| B.c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
| C.c(K+)>c(CO32-)>c(H+)>c(OH-) |
| D.c(K+)>c(CO32-)>c(OH-)>c(HCO3-) |
(1)硫酸;
(2)①Cu2++2e-═Cu;乙;
②O2;CH4-8e-+10OH-=CO32-+7H2O;0.28L;
(3)BD.
解析试题分析:(1)硫酸铜水解生成氢氧化铜而使溶液浑浊,加少量硫酸抑制硫酸铜水解。(2)图一中Zn是负极、Cu是正极。Cu极电极反应为Cu2++2e-=Cu。盐桥中阳离子向正极迁移。图二中左边是燃料电池,右边是电解池。要实现铁上镀铜,则铁作阴极,铜作阳极,所以a处通CH4、b处通O2。A处电极反应为CH4-8e-+10OH-=CO32-+7H2O。4Cu~8e-~CH4,所以当铜溶解0.05mol时,消耗CH40.0125mol。(3)碳酸钾溶液中电荷守恒式为c(K+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),A错误;物料守恒式为c(K+)= 2c(CO32-)+ 2c(HCO3-)+2c(H2CO3),E错误;将电荷守恒与物料守恒相减消去c(K+)得c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3),B正确;K2CO3溶液中CO32-+H2O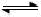 HCO3-+ OH-、HCO3-+H2O
HCO3-+ OH-、HCO3-+H2O H2CO3+OH-,离子浓度大小关系为c(K+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),D正确、C错误。
H2CO3+OH-,离子浓度大小关系为c(K+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),D正确、C错误。
考点:盐类的水解 电化学 离子浓度比较
点评:电解池中与电源正极相连的是阳极、与电源负极相连的是阴极;串联电路中电流强度处处相等,每个电极上转移电子数相等。


科目:高中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 Cu(OH)2+2H+
Cu(OH)2+2H+ Cu(OH)2+2H+
Cu(OH)2+2H+
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
(13 分)
(1)CuSO4溶液是中学化学及工农业生产中常见的一种试剂。某同学利用CuSO4溶液,进行以下实验探究。
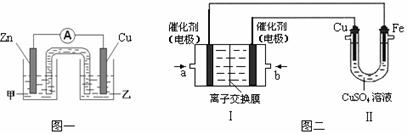
① 图一是根据反应Zn + CuSO4 = Cu + ZnSO4设计成的锌铜原电池。电解质甲溶液是 (填“ZnSO4”或“CuSO4”)溶液;Cu极的电极反应式是 。
②图二中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜,则b处通入的是 (填“CH4”或“O2”),a处电极上发生的电极反应式是 。
(2)将蓝矾(CuSO4·5H2O)、生石灰和水按一定比例混合,即可得到波尔多液(杀菌剂),其 有效成分为难溶的碱式硫酸铜[xCuSO4·yCu(OH)2]。为测定某碱式硫酸铜的组成进行了如下实验:取等质量的碱式硫酸铜样品两份,一份滴加稀盐酸至恰好完全溶解,另一份高温灼烧后只得到CuO固体。所得数据显示n(HCl)︰n(CuO)=3︰2,则该碱式硫酸铜的化学式中x︰y= 。
(3)E是非金属性最强的元素,M是E的气态氢化物,在固定体积的密闭容器中,气体M存在如下关系:
xM(g)![]() Mx(g),反应物和生成物的物质的量随时间的变化关系如下图。下 列说法正确的是
Mx(g),反应物和生成物的物质的量随时间的变化关系如下图。下 列说法正确的是
A.该反应的化学方程式是2HF![]() (HF)2
(HF)2
B.平衡时混合气体的平均摩尔质量是33.3
C.t1时刻,保持温度不变,再充入1molM,重新达到平衡时,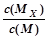 将增大
将增大
D.M的沸点比同主族下一周期元素的气态氢化物沸点低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com