
| A. | 1:2:3 | B. | 6:3:2 | C. | 3:1:1 | D. | 1:1:1 |
分析 Na和稀盐酸、水都反应,Fe和Al分别与稀盐酸反应方程式为Fe+2HCl=FeCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑,0.30molFe、Al完全反应需要盐酸的物质的量分别是0.06mol、0.09mol,实际上n(HCl)=0.1mol/L×0.1L=0.01mol,所以Fe和Al都剩余,计算生成氢气物质的量,相同条件下气体体积之比等于物质的量之比.
解答 解:Na和稀盐酸、水都反应,Fe和Al分别与稀盐酸反应方程式为Fe+2HCl=FeCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑,0.30molFe、Al完全反应需要盐酸的物质的量分别是0.06mol、0.09mol,实际上n(HCl)=0.1mol/L×0.1L=0.01mol,所以Fe和Al都剩余,
根据2Na~H2↑可知,0.03molNa完全反应,生成氢气的物质的量=0.03mol×$\frac{1}{2}$=0.015mol,
Fe和Al都剩余,所以二者与酸反应生成氢气的量相等,根据氢原子守恒,可知生成氢气的量=$\frac{0.01mol}{2}$=0.005mol,
所以同温同压下产生的气体的物质的量之比=0.015mol:0.005mol:0.005mol=3:1:1,
故选C.
点评 本题考查了根据方程式计算,涉及过量计算问题,注意钠和稀盐酸、水都反应,难度不大.


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案科目:高中化学 来源: 题型:选择题
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤⑥⑦ | B. | ①③④⑤ | C. | ②④⑤ | D. | ①②⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为了使火腿肠颜色更鲜红,可多加一些亚硝酸钠 | |
| B. | 为了使婴儿对食品有浓厚兴趣,我们可以在婴儿食品中加少量着色剂 | |
| C. | 服用阿斯匹林后出现胃肠道反应是中毒的表现,应立即停药 | |
| D. | 为保证人体所需足够蛋白质我们要多吃肉,少吃蔬菜和水果 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
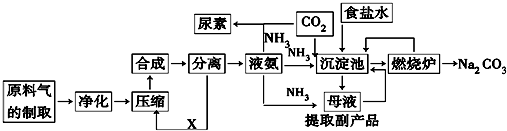
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
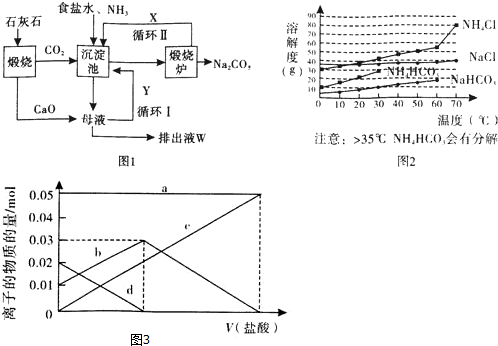
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
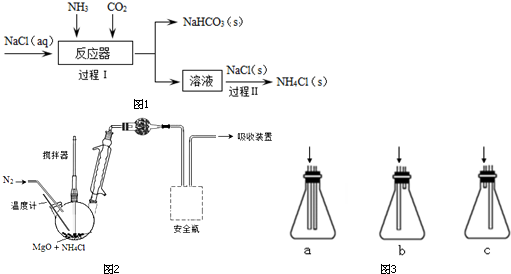
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
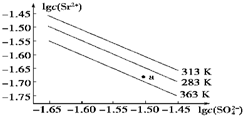
| A. | 温度一定时,Ksp(SrSO4)随c(SO42- )的增大而减小 | |
| B. | 三个不同温度中,313 K时Ksp(SrSO4)最大 | |
| C. | 283 K时,图中a点对应的溶液是饱和溶液 | |
| D. | 283 K下的SrSO4饱和溶液升温到363 K后变为不饱和溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com