
【题目】制造保险丝时,在铅中加入锑和少量其他金属的最主要原因是( )
A.升高熔点 B.降低熔点
C.减小硬度 D.增强抗腐蚀能力
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.活化分子间的碰撞一定是有效碰撞
B.活化分子具有的能量是活化能
C.活化分子的总数越多,反应速率越快
D.单位时间内有效碰撞次数越多,反应速率越快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物PAS-Na是一种治疗肺结核药物的有效成分,有机物G是一种食用香料,以甲苯为原料合成这两种物质的路线如下:
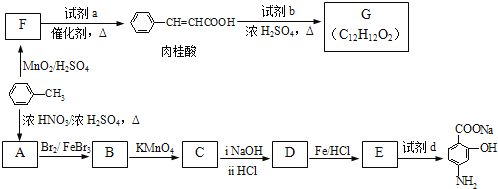
已知:①![]()
![]()
![]()
②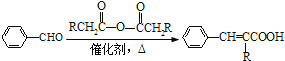 (R=-CH3或-H)
(R=-CH3或-H)
③![]()
![]()
![]()
回答下列问题:
(1)![]() 生成A的反应类型是______________。
生成A的反应类型是______________。
(2)F中含氧官能团的名称是______________,试剂a的结构简式为______________。
(3)写出由A生成B的化学方程式______________。
(4)质谱图显示试剂b的相对分子质量为58,分子中不含甲基,且为链状结构,写出肉桂酸与试剂b生成G的化学方程式:______________。
(5)当试剂d过量时,可以选用的试剂d是______________(填字母序号).
a.NaHCO3 b.NaOH c.Na2CO3
(6)肉桂酸有多种同分异构体,符合下列条件的有______________种。
a.苯环上有三个取代基;b.能发生银镜反应,且1mol该有机物最多生成4mol Ag。
由上述符合条件的同分异构体中,写出苯环上有两种不同化学环境氢原子的有机物的结构简式________(任写一种即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓H2SO4 密度1.84g/mL,物质的量浓度为18.4mol/L,质量分数为98%,取10mL浓H2SO4和a mL水混合得物质的量浓度为C mol/L,质量分数为b%.下列组合正确的是( )
(1)若C=9.2则a>10 b>49%
(2)若C=9.2则a>10 b<49%
(3)若b=49则a=18.4 C<9.2
(4)若b=49则a=18.4 C>9.2.
A.(1)(3) B.(1)(4) C.(2)(3) D.(2)(4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到的气体其物质的量为a mol,向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0g,若上述气体为NO和NO2的混合物,且体积比为1:1(在相同条件下),则a可能为( )
A.0.80 B.0.70 C.0.60 D.0.40[
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由两种盐组成的白色粉末混合物,加热时无气体逸出。其焰色反应呈黄色,透过蓝色钴玻璃可观察到紫色。取此白色粉末加硝酸时,粉末完全溶解,生成的无色无味的气体可使澄清石灰水变浑浊。在上述粉末溶于过量的硝酸后的溶液中加入硝酸银溶液,有白色沉淀生成。试推断该混合物的可能组成,并简要说明理由。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F为前4周期的6种元素,原子序数依次增大,其中A位于周期表的s的区,其原子中电子层数和未成对电子数相同;B原子价电子排布式为nsnnpn,B和E同主族,D原子的最外层电子数是其内层的3倍;F元素位于元素周期表的第4行、第11列。试回答下列问题:
(1)基态F原子的核外电子排布式为 。
(2)关于B2A2的下列说法中正确的是 (填选项序号)。
①B2A2中的所有原子都满足8电子稳定结构
②每个B2A2分子中σ键和π键数目比为1:1
③B2A2是由极性键和非极性键构形成的非极性分子
④B2A2中心原子的杂化类型为sp杂化
(3)B、C、D三种元素第一电离能由大到小的顺序排列为 (用元素符号表示)。
(4)C的单气态氢化物与C的最高价氧化物对应的水化物反应生成一种盐H,H晶体中存在的化学键类型有 (填选项序号)。
①离子键 ②共价键 ③氢键 ④配位键 ⑤金属键
(5)基态E原子的最高能层具有的原子轨道数为 ;B和E的最高价氧化物中,熔沸点较高的是 (写化学式);
(6)F单质的晶体堆积方式为面心立方最密堆积,其配位数为 ;若F的相对分子质量为M,它的晶胞棱长为acm,则F晶体的密度为 g·cm-3。(阿伏伽德罗常数为NA)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com