
| A. | 仅(1)(2) | B. | (1)(2)(3) | C. | (1)(2)(3)(4) | D. | 以上都不相同 |
分析 乙烯的分子式为C2H4,相对分子质量为28,一氧化碳的分子式为:CO,相对分子质量为28,等质量的乙烯和一氧化碳的物质的量相等,据此判断原子个数,体积和密度和条件有关.
解答 解:(1)乙烯的分子式为C2H4,相对分子质量为28,一氧化碳的分子式为:CO,相对分子质量为28,等质量的乙烯和一氧化碳的物质的量相等,故正确;
(2)气体的体积和温度、压强有关,相同条件下,物质的量相同,则体积相同,故正确;
(3)二者质量相同,体积相同,所以密度相同,故C正确;
(4)乙烯的分子式为C2H4,一氧化碳的分子式为:CO,等质量的乙烯和一氧化碳的物质的量相等,所含原子个数比为3:1,故错误;
故选B.
点评 本题考查了物质的量的计算,题目难度不大,注意把握物质的量的有关公式,本题要注意体积、密度和温度、压强有关.


科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
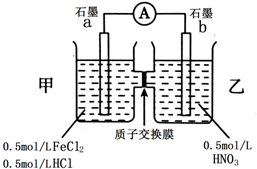
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com