
NA表示阿伏加德罗常数的值,下列说法正确的是
A.5.6 g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA
B.2.5mL 16mol·L-1浓硫酸与足量铜反应,转移电子数为0.04NA
C.7.8g Na2S和Na2O2的固体混合物中含有的阴离子数等于0.1NA
D.常温下,5.6 g 铁钉与足量浓硝酸反应,转移的电子数为0.3 NA
 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案科目:高中化学 来源:2017届江西省、宜春一中高三7月联考化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.1L水中溶解了58.5g NaCl,该溶液的物质的量浓度为1mol/L
B.V L Fe2(SO4)3溶液中含a g SO42-,取此溶液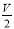 L用水稀释成2V L,则稀释后溶液的c(Fe3+)为
L用水稀释成2V L,则稀释后溶液的c(Fe3+)为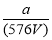 mol/L
mol/L
C.已知某NaCl溶液的密度是1.17 g/cm3,可求出此溶液的物质的量浓度
D.把100mL20%的NaOH溶液跟100mL10%的NaOH 混合后,可判断NaOH混合溶液的质量分数等于15%
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三7月暑期阶段性测试化学试卷(解析版) 题型:选择题
某白色粉末由两种物质组成,为鉴别其成分进行如下实验:①取少量样品加入足量水仍有部分固体未溶解;再加入足量稀盐酸,有气泡产生,固体全部溶解;②取少量样品加入足量稀硫酸有气泡产生,振荡后仍有固体存在。该白色粉末可能为
A.NaHCO3、Al(OH)3 B.AgCl、NaHCO3
C.Na2SO3 、BaCO3 D.Na2CO3、CuSO4
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三入学考试理综化学试卷(解析版) 题型:选择题
在一定条件下4mol乙酸与1mol葡萄糖,完全反应得到1mol葡萄糖醋酸酯,则该葡萄糖醋酸酯的分子式为
A.C14H18O10 B.C14H20O9 C.C14H20O10 D.C14H22O10
查看答案和解析>>
科目:高中化学 来源:2017届湖南衡阳八中高三实验班暑期第一次月考理综化学(解析版) 题型:选择题
在100mLHNO3和H2SO4的混合溶液中,两种酸的物质的量浓度之和为0.6mol/L。向该溶液中加入足量的铜粉,加热,充分反应后,所得溶液中Cu2+的物质的量浓度最大值为(反应前后溶液体积变化忽略不计)
A.0.225mol/L B.0.30mol/L C.0.36mol/L D.0.45mol/L
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省大连市高二下期末化学试卷(解析版) 题型:填空题
新型储氢材料是开发利用氢能的重要研究方向.
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态Cl原子中,电子占据的最高能层符号为 ,该能层具有的原子轨道数为 .
②LiBH4由Li+和BH4﹣构成,BH4﹣的立体结构是 ,B原子的杂化轨道类型是 .
Li、B、H元素的电负性由大到小排列顺序为 .
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径Li+ H﹣(填“>”、“=”或“<”).②某储氢材料是第三周期金属元素M的氢化物.M的部分电离能如表所示:
I1/kJ•mol﹣1 | I2/kJ•mol﹣1 | I3/kJ•mol﹣1 | I4/kJ•mol﹣1 | I5/kJ•mol﹣1 |
738 | 1451 | 7733 | 10540 | 13630 |
M是 (填元素符号).
(3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488pm(棱长),Na+半径为102pm,H﹣的半径为 ,NaH的理论密度是 g•cm﹣3(只列算式,不必计算出数值,阿伏加德罗常数为NA)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省大连市高二下期末化学试卷(解析版) 题型:选择题
选项 | 实验 | 现象 | 结论 |
A | SO2通入BaCl2溶液,然后滴入稀硝酸 | 产生白色沉淀,加入稀硝酸沉淀不溶解 | 开始的沉淀为BaSO3,后来转化为BaSO4 |
B | KBrO3溶液中加入少量苯,然后通入少量Cl2振荡 | 静止后有机相呈橙色 | 氧化性:Cl2>Br2 |
C | 向足量含淀粉的FeI2溶液中滴加2滴氯水 | 溶液变蓝 | 还原性:I﹣>Fe2+ |
D | 将重晶石浸泡在饱和碳酸钠溶液中 | 一段时间后固体溶解 | Ksp(BaCO3)<Ksp(BaSO4) |
A.A B.B C.C D.D
查看答案和解析>>
科目:高中化学 来源:2017届河北沧州市高三上学期第一次月考化学试卷(解析版) 题型:填空题
(14分)下表为元素周期表的一部分。
碳 | 氮 | Y |
|
X |
| 硫 | Z |
回答下列问题:
(1)Z元素在周期表中的位置为 。
(2)表中元素原子半径最大的是(写元素符号) 。
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是 。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)碳与镁形成的1mol化合物Q与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,烃的电子式为 。Q与水反应的化学方程式为 。
(5)X与Z两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式 。
(6)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由表中两种元素组成,气体的相对分子质量都小于50。为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1L 2.2mol/LNaOH溶液和1molO2,则两种气体的分子式及物质的量分别为 ,生成硫酸铜物质的量为 。
查看答案和解析>>
科目:高中化学 来源:2017届湖南长沙一中高二上第一次月考(开学考试)化学卷(解析版) 题型:选择题
下列物质的转化在给定条件下能实现的是( )
A.NaCl(aq) NaHCO3(s)
NaHCO3(s)  Na2CO3(s)
Na2CO3(s)
B.CuCl2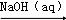 Cu(OH)2
Cu(OH)2 Cu
Cu
C.Al 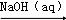 NaAlO2(aq)
NaAlO2(aq)  NaAlO2(s)
NaAlO2(s)
D.MgO(s)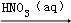 Mg(NO3)2(aq)
Mg(NO3)2(aq)  Mg(s)
Mg(s)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com