
| A. | 物质的量:④<①<②<③ | B. | 体积:④<①<③<② | ||
| C. | 质量:④<①<③<② | D. | 氢原子个数:②<④<③<① |
分析 A.根据n=$\frac{V}{Vm}$计算6.72LCH4的物质的量,根据n=$\frac{N}{{N}_{A}}$计算HCl的物质的量,根据n=$\frac{m}{M}$计算13.6gH2S的物质的量;
B.相同条件下体积之比等于物质的量之比;
C、根据m=nM计算甲烷、HCl、氨气的质量;
D、根据各分子含有的H原子数目,计算各物质含有的H原子物质的量,以此来解答.
解答 解:①6.72L CH4的物质的量为$\frac{6.72L}{22.4L/mol}$=0.3mol,②3.01×1023 个HCl分子的物质的量为$\frac{3.01×1{0}^{23}}{6.02×1{0}^{23}}$=0.5mol,③13.6g H2S的物质的量为$\frac{13.6g}{34g/mol}$=0.4mol,④0.2mol NH3.
A.由上述计算可知,物质的量为④<①<③<②,故A错误;
B.根据V=nVm知,相同条件下体积之比等于物质的量之比,故体积④<①<③<②,故B正确;
C.甲烷质量为0.3mol×16g/mol=4.8g,HCl的质量为0.5mol×36.5g/mol=33.25g,氨气的质量为0.2mol×17g/mol=3.4g,故质量④<①<③<②,故C正确;
D.甲烷中n(H)=0.3mol×4=1.2mol,HCl中n(H)=0.5mol,硫化氢中n(H)=0.4mol×2=0.8mol,氨气中n(H)=0.2mol×3=0.6mol,故H原子数目②<④<③<①,故D正确;
故选A.
点评 本题考查物质的量的计算,为高频考点,把握体积、物质的量、质量、微粒数目的关系及相关计算公式为解答本题的关键,侧重分析与计算能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ①②⑤③ | B. | ②③④③ | C. | ②③⑤③ | D. | ①③⑤③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
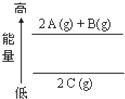
| A. | 2A(g)+B(g)=2 C(g)△H<0 | B. | 2A(g)+B(g)=2 C(g)△H>0 | C. | 2C(g)=2A(g)+B(g)△H>0 | D. | 2C(g)=2 A(g)+B(g)△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| B. | NH4HCO3溶液与过量KOH浓溶液共热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 稀硝酸和过量的铁屑反应:3 Fe+8H++2 NO3-=3 Fe3++2 NO↑+4 H2O | |
| D. | 大理石溶于醋酸的反应:CaCO3+CH3COOH=Ca2++2CH3COO-+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NaClO3在反应中化合价降低,失去电子 | |
| B. | SO2在反应中发生氧化反应 | |
| C. | 2mol氧化剂在反应中得到2mol电子 | |
| D. | H2SO4在反应中作氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA | |
| B. | 在常温常压下,11.2升氯气含有的分子数为0.5NA | |
| C. | 在常温常压下,1摩尔气体含有的原子数为NA | |
| D. | 在同温同压下,相同体积的任何气体单质所含原子数目相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
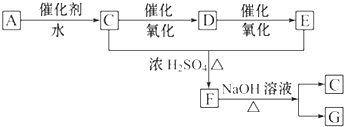
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com