
【题目】化学与科技、社会、生产、生活等关系密切,下列有关说法不正确的是( )
A.部分卤代烃可用作灭火剂
B.福尔马林(甲醛溶液)可用于浸泡生肉及海产品以防腐保鲜
C.提倡人们购物时不用塑料袋,是为了防止白色污染
D.石油分馏是物理变化,可得到汽油、煤油和柴油等产品
 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1。请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1。请回答下列问题:
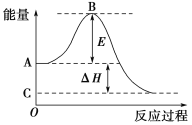
(1)图中A点表示:________________________________________;
C点表示:________________。E的大小对该反应的反应热________(填“有”或“无”)影响。
(2)图中ΔH=________kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下利说法正确的是(NA表示阿伏加德罗常数的值)
①28g氮气所含有的原子数目为NA
②4g金属钙变成钙离子时失去的电子数目为0.1 NA
③在常温常压下,11.2LN2含有含有的分子数为0.5NA
④在标况下,1 molNe含有的原子数为NA
⑤0.5 mol单质铝与足量盐酸反应转移电子数为1.5NA
⑥标准状况下,1 L水所含分子数为1 /22.4NA
⑦17g氨气所含电子数目为10NA
A. ①②⑤⑥⑦ B. ①②④⑤⑥ C. ⑤⑦ D. ④⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关NaClO和NaCl混合溶液的叙述正确的是( )
A. 该溶液中,H+、NH![]() 、SO
、SO![]() 、Br-可以大量共存
、Br-可以大量共存
B. 该溶液中,Ag+、K+、NO![]() 、CH3CHO可以大量共存
、CH3CHO可以大量共存
C. 向该溶液中滴入少量FeSO4溶液,反应的离子方程式为:2Fe2++ClO-+2H+===Cl-+2Fe3++H2O
D. 向该溶液中加入浓盐酸,每产生1 mol Cl2,转移电子约为6.02×1023个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:

(1)表中硫酸的质量分数W1为_____(不写单位,用含c1、p1的代数式表示)。
(2)物质的量浓度为c1mol· L-1质量分数为w1的硫酸与水等体积混合(混合后溶液体积变化忽略不计),所得溶液的物质的量浓度为________ mol· L-1,质量分数_______w1/2(填“大于”、“小于”或“等于”,下同)。
(3)质量分数为w2的氨水与w2/5的氨水等质量混合,所得溶液的密度_____![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)18.6gNa2X含有0.6molNa+,则X的相对原子质量为___________,该物质的化学式__________。
(2)2molCO(NH2)2中含_____mol碳原子,_____mol氧原子,_____mol氮原子,____mol氢原子,所含氧原子数跟_____molH2O中所含氧原子数相等。
(3)已知 1.204×1023 个 X 气体分子的质量为 8g,则 X 气体的摩尔质量是__________。
(4)同温同压下,同体积的N2和SO2分子数之比为__________________,物质的量之比为____________,原子总数之比为____________,摩尔质量之比为__________,质量之比为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸钠在轻工、建材、纺织、国防、医药等工业中有重要的应用。
(1)工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO![]() 等杂质,提纯工艺线路如下:
等杂质,提纯工艺线路如下:
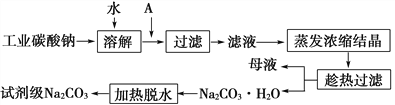
碳酸钠的饱和溶液在不同温度下析出的溶质如图所示:
![]()
请回答下列问题:
①试剂A是________,“母液”中除了含有Na+、CO![]() 、OH-外,还含有________等离子,过滤要“趁热”的目的是____________________________。
、OH-外,还含有________等离子,过滤要“趁热”的目的是____________________________。
②检验试剂级Na2CO3中Cl-和SO![]() 是否除尽,选用的试剂及加入的先后次序是________(填字母)。
是否除尽,选用的试剂及加入的先后次序是________(填字母)。
a.HCl、BaCl2、AgNO3
b.AgNO3、HNO3、Ba(NO3)2
c.HNO3、Ba(NO3)2、AgNO3
d.AgNO3、HCl、BaCl2
(2)“侯氏制碱法”的原理:NaCl+NH3+CO2+H2O===NaHCO3↓+NH4Cl
如图是某兴趣小组在实验室中模拟“侯氏制碱法”制取NaHCO3所用到的主要装置。
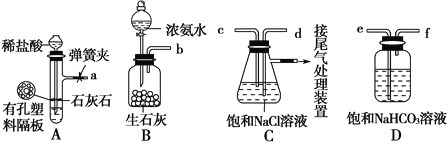
请回答下列问题:
①各仪器口的连接顺序为a接___________________________________接b,实验时先向NaCl溶液中通入较多的NH3,再通入足量的CO2,其原因是________(填字母)。
a.使CO2更易被吸收
b.NH3比CO2更易制取
c.CO2的密度比NH3大
②将生成的NaHCO3晶体从混合物中分离出来需要的玻璃仪器是_______________。
③该兴趣小组用如图装置比较C、N、Si三种元素的非金属性强弱,B中的试剂是________,能说明碳的非金属性比硅强的实验现象是_______________________(H2SiO3是一种不溶于水的白色胶状物)。
查看答案和解析>>
科目:高中化学 来源: 题型:
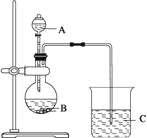
【题目】微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是

A. 正极反应中有CO2生成
B. 微生物促进了反应中电子的转移
C. 质子通过交换膜从负极区移向正极区
D. 电池总反应为C6H12O6+6O2=6CO2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A. 将铜丝插入稀硝酸中:Cu+4H++2NO![]() ===Cu2++2NO2↑+H2O
===Cu2++2NO2↑+H2O
B. NaHCO3溶液中加少量Ba(OH)2溶液:HCO![]() +Ba2++OH-===BaCO3↓+H2O
+Ba2++OH-===BaCO3↓+H2O
C. 硫化钠水溶液呈碱性:S2-+2H2O===H2S↑+2OH-
D. 在酸性碘化钾溶液中滴加双氧水:2I-+2H++H2O2===I2+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com