
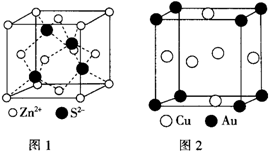
 1967年舒尔滋提出金属互化物的概念,其定义为固相金属间化合物拥有两种或两种以上的金属元素,如Cu9Al4、Cu5Zn8等.回答下列问题:
1967年舒尔滋提出金属互化物的概念,其定义为固相金属间化合物拥有两种或两种以上的金属元素,如Cu9Al4、Cu5Zn8等.回答下列问题:| m |
| V |
| 1 |
| 2 |
| 1 |
| 8 |
| m |
| V |
| ||
| a3×10-21 |
| 389 |
| NA?a3×10-21 |
| 389 |
| NA?a3×10-21 |


科目:高中化学 来源: 题型:
| A、1 L 水中溶解了58.5 g NaCl,该溶液的物质的量浓度为1 mol/L |
| B、从1 L 2 mol/L的H2SO4溶液中取出0.5 L,该溶液的浓度为1 mol/L |
| C、配制500 mL 0.2 mol/L的CuSO4溶液,需称量CuSO4固体的质量为16.0g |
| D、中和100 mL 1 mol/L的H2SO4溶液,需NaOH的质量为4.0g |
查看答案和解析>>
科目:高中化学 来源: 题型:
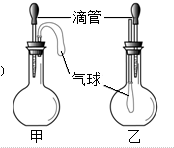
| A、甲:NaOH溶液和CO2,乙:H2O2和MnO2 |
| B、甲:CaCl2和Na2CO3溶液,乙:NaOH溶液和Cl2 |
| C、甲:浓硫酸和铝片.乙:浓氨水和SO2 |
| D、甲:浓硫酸和蔗糖.乙:水和氯化氢气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀 | 1.3 | 3.3 | 7.5 | 10.3 |
| 完全沉淀 | 2.8 | 5.2 | 9.7 | 12.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 反应mX(g)?nY(g)+pZ(g)△H,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示.下列说法错误的是( )
反应mX(g)?nY(g)+pZ(g)△H,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示.下列说法错误的是( )| A、该反应的△H>O |
| B、m<n+p |
| C、B、C两点化学平衡常数:KB>KC |
| D、A、C两点的反应速率v(A)<v(C) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com