
【题目】NO2、NO、CO、NO2-等是常见大气污染物和水污染物,研究NO2、NO、CO、NO2-等的处理对建设美丽中国具有重要意义。
已知:①NO2+CO![]() CO2+NO,该反应的平衡常数为K1(下同)。断开1mol下列物质的所有化学键时所消耗能量分别为:
CO2+NO,该反应的平衡常数为K1(下同)。断开1mol下列物质的所有化学键时所消耗能量分别为:
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
②![]() N2(g)+
N2(g)+ ![]() O2(g)
O2(g)![]() NO(g) △H=+89.75kJ/mol,K2
NO(g) △H=+89.75kJ/mol,K2
③2NO(g)+O2(g)![]() 2NO2(g) △H=-112.3kJ/mol,K3
2NO2(g) △H=-112.3kJ/mol,K3
写出NO与CO反应生成无污染气体的热化学方程式:_____________,此热化学方程式的平衡常数K=_______(用K1、K2、K3表示)
(2)污染性气体NO2与CO在一定条件下的反应为2NO2+4CO![]() 4CO2+N2,某温度下,在1L密闭容器中充入0.1molNO2和0.2molCO,此时容器的压强为1个大气压,5秒时反应达到平衡,容器的压强变为原来的
4CO2+N2,某温度下,在1L密闭容器中充入0.1molNO2和0.2molCO,此时容器的压强为1个大气压,5秒时反应达到平衡,容器的压强变为原来的![]() ,则反应开始到平衡时CO的平均反应速率v(CO)=_______。若此温度下,某时刻则得NO2、CO、CO2、N2的浓度分别为amol/L、0.4mol/L、0.1mol/L、1mol/L,要使反应向逆反应方向进行,a的取值范围为________。
,则反应开始到平衡时CO的平均反应速率v(CO)=_______。若此温度下,某时刻则得NO2、CO、CO2、N2的浓度分别为amol/L、0.4mol/L、0.1mol/L、1mol/L,要使反应向逆反应方向进行,a的取值范围为________。
(3)研究发现:NOx是雾霾的主要成分之一,NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。已知:4NH3(g)+6NO(g)=5N2(g)+6H2O(g) △H=-1810kJ/mol
①相同条件下,在2L恒容密闭容器中,选用不同的催化剂,上述反应产生N2的物质的量随时间变化的情况如图所示。
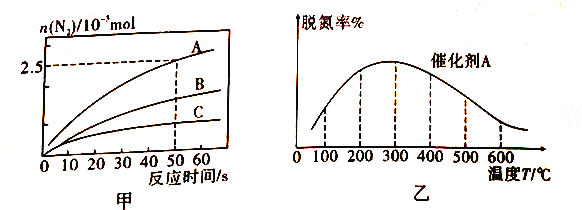
a.在催化剂A作用下,反应达到平衡的标志是_____(填序号)。
A.4v(NH3)正=6v(H2O)逆
B.容器内总压强不再改变
C.容器内密度不再改变
D.NO 和H2O(g)浓度相等
E.容器内平均摩尔质量不再改变
b.在A、B,C 三种催化剂下,清除氮氧化物反应的活化能分别表示为Ea(A)、Ea(B)、Ea(C),根据图甲所示曲线,判断三种催化剂条件下,活化能由大到小的顺序为________。
②在氨气足量时,反应在催化剂A 作用下,经过相同时间,测得脱氮潮殖反应温度的变化情况如图乙所示,据图可知,自相同的时间内,温度对脱氮率的影响及可他的原因是________。(已知A、B催化剂在此温度范围内不失效)。
【答案】 2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=759.8kJ/mol ![]() 0.008mol·L1·s1 0≤a<0.8 BE Ea(C)>Ea (B)>Ea (A) 300℃之前,反应未达平衡,反应正向进行,脱氮率随温度的升高而升高;300℃后,反应达到平衡,升温,平衡逆向移动,脱氮率减小
0.008mol·L1·s1 0≤a<0.8 BE Ea(C)>Ea (B)>Ea (A) 300℃之前,反应未达平衡,反应正向进行,脱氮率随温度的升高而升高;300℃后,反应达到平衡,升温,平衡逆向移动,脱氮率减小
【解析】(1)由已知,反应①的△H=(812+1076-1490-632)kJ/mol=-234kJ/mol,根据盖斯定律,由反应①×2+③-②×2可得:2NO2(g)+2CO(g) ![]() N2(g)+2CO2(g) △H=[-234×2+(-112.3)-179.5]kJ/mol=-759.8kJ/mol;当总反应式相加时平衡常数相乘,相减时平衡常数相除,成倍时平衡常数为幂,所以平衡常数K=
N2(g)+2CO2(g) △H=[-234×2+(-112.3)-179.5]kJ/mol=-759.8kJ/mol;当总反应式相加时平衡常数相乘,相减时平衡常数相除,成倍时平衡常数为幂,所以平衡常数K= ![]() ;(2)5s内反应消耗0.04mol CO,所以
;(2)5s内反应消耗0.04mol CO,所以![]() ,平衡常数
,平衡常数![]() ,a<0.8,所以,0≤a<0.8;(3)①a.A、4v(NH3)正=6v(H2O)逆,正逆反应速率之比不等于化学计量数之比,反应未达平衡状态,选项A错误;B.该反应为气体体积可变的反应,当容器内总压强不再改变,说明反应已达平衡状态,选项B正确;C.反应在恒容容器中进行且气体总质量不变,反应过程密度始终保持不变,容器内密度不再改变不能说明反应达平衡状态,选项C错误;D.NO 和H2O(g)浓度相等是一种特殊情况,反应不一定达平衡状态,选项D错误;E. 该反应为气体体积可变的反应,气体总质量不变,当容器内总物质的量不再改变,容器内平均摩尔质量不再改变,则反应达平衡状态,选项E正确。答案选BE;b.反应活化能越小,反应速率越快,由图可以看出v(A)>v(B)>v(C),Ea(C)>Ea (B)>Ea (A);②300℃之前,反应未达平衡,脱氮率随温度的升高而升高;300℃后,反应达到平衡,升温,脱氮率减小,说明正反应放热,所以,升温平衡逆向移动,脱氮率减小。
,a<0.8,所以,0≤a<0.8;(3)①a.A、4v(NH3)正=6v(H2O)逆,正逆反应速率之比不等于化学计量数之比,反应未达平衡状态,选项A错误;B.该反应为气体体积可变的反应,当容器内总压强不再改变,说明反应已达平衡状态,选项B正确;C.反应在恒容容器中进行且气体总质量不变,反应过程密度始终保持不变,容器内密度不再改变不能说明反应达平衡状态,选项C错误;D.NO 和H2O(g)浓度相等是一种特殊情况,反应不一定达平衡状态,选项D错误;E. 该反应为气体体积可变的反应,气体总质量不变,当容器内总物质的量不再改变,容器内平均摩尔质量不再改变,则反应达平衡状态,选项E正确。答案选BE;b.反应活化能越小,反应速率越快,由图可以看出v(A)>v(B)>v(C),Ea(C)>Ea (B)>Ea (A);②300℃之前,反应未达平衡,脱氮率随温度的升高而升高;300℃后,反应达到平衡,升温,脱氮率减小,说明正反应放热,所以,升温平衡逆向移动,脱氮率减小。


 每课必练系列答案
每课必练系列答案科目:高中化学 来源: 题型:
【题目】在25 mL 0.1 mol/L的NaOH溶液中逐滴加入0.2 mol/L醋酸溶液,曲线如图所示,有关粒子的浓度关系正确的是
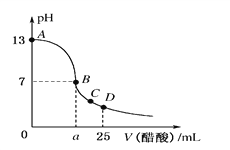
A. 在A、B间任一点,溶液中一定都有c(Na+)>c(CH3COO-)> c(H+) >c(OH-)
B. 在B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C. 在C点:c(CH3COO-)>c(Na+)> c(OH-) > c(H+)
D. 在D点:c(CH3COO-)+c(CH3COOH)=2c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(g)+5B(g)![]() 4C(g)+6D(g),在5 L的密闭容器中进行,半分钟后,C的物质的量增加了0.30 mol。下列叙述正确的是( )
4C(g)+6D(g),在5 L的密闭容器中进行,半分钟后,C的物质的量增加了0.30 mol。下列叙述正确的是( )
A. A的平均反应速率是0.010 molL﹣1s﹣1
B. 容器中含D物质的量至少为0.45 mol
C. 容器中A、B、C、D的物质的量的比一定是4∶5∶4∶6
D. 容器中A的物质的量一定增加了0.30 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.只含有一种元素的物质一定是纯净物
B.含有共价键的化合物一定是共价化合物
C.石墨转变为金刚石为化学变化
D.水很稳定是因为水分子间存在较强的分子间作用力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以有机化合物A为初始原料,合成有机化合物C和F的路线如图所示:
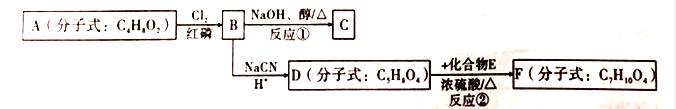
已知以下信息:
①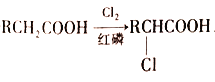 ,R-Cl
,R-Cl![]() R—COOH,其中R表示烃基;
R—COOH,其中R表示烃基;
②D的核磁共振氢谱有两种不同化学环境的氢;
③F为七元环状化合物。
回答下列问题:
(1)A中含有的官能团名称为________;1molA完全燃烧消耗O2________mol.
(2)判断反应类型:反应①为_________;反应②为_________。
(3)E的结构简式为_________;F的结构简式为_________。
(4)由B生成C的化学方程式为_________。
(5)请写出满足下列条件的D的2种链状同分异构体的结构简式: _________。
①可发生水解反应;②核磁共振氢谱显示有两组峰,且峰面积之比为1:3。
(6)利用该合成路线中的有关信息,写出以乙醇为初始原料,其他无机试剂任选,制备有机化合物CH2=CHCOOH的合成路线流程图:(流程图示例:CH3CH2OH![]() H2C=CH2
H2C=CH2![]() BrH2C—CH2Br)________________
BrH2C—CH2Br)________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来AIST报告正在研制一种“高容量、低成本”锂-铜空气燃料电池。该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )

A. 放电时,Li+透过固体电解质向Cu极移动
B. 放电时,负极的电极反应式为Cu2O+H2O+2e-=2Cu+2OH-
C. 通空气时,铜被腐蚀,表面产生Cu2O
D. 整个反应过程中,铜相当于催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学帮助水质检测站配制480mL 0.5mol·L-1 NaOH溶液以备使用。
(1).该同学应选择__________mL的容量瓶。
(1).其操作步骤如乙图所示,则甲图操作应在乙图中的__________(填选项字母)之间。
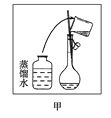
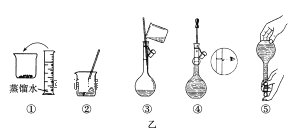
A.②与③B.①与②C.③与④
(1). 该同学应称取NaOH固体__________g,用质量为23.1g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小__________(填字母),并在如图中选出能正确表示游码位置的选项__________(填字母)。
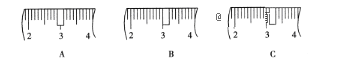
a | b | c | d | e | |
砝码大小/g | 100 | 50 | 20 | 10 | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,按化合物、单质、混合物顺序排列的是( )
A.烧碱、液态氧、碘酒
B.生石灰、白磷、熟石灰
C.干冰、铁、氯化氢
D.空气、氮气、胆矾
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com