
��ͼ�Dz��ֶ�����Ԫ�صij������ϼ���ԭ�������Ĺ�ϵͼ��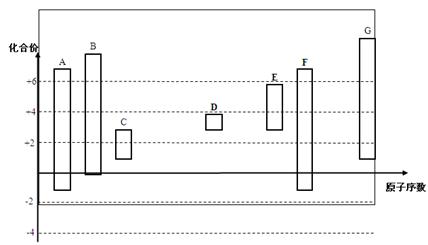
��1��Ԫ��A�����ڱ��е�λ�� ��
��2���õ���ʽ��ʾD2G���γɹ��� ��������ѧ������Ϊ ��
��3��C2-��D+��G2-���Ӱ뾶��С˳���� > > �������ӷ��Żش�
��4��ijͬѧ���ʵ��֤��A��B��F�ķǽ�����ǿ����ϵ�� 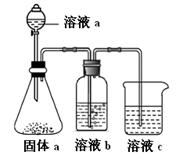
�� ��Һa��b�ֱ�Ϊ �� ��
�� ��Һc�е����ӷ���ʽΪ ��
�����ԭ�ӽṹ�ĽǶȽ��ͷǽ�����B > A��ԭ�� ��
��5����0.5 mol D2C2Ͷ��100 mL 3 mol/L ECl3��Һ��
�� ת�Ƶ��ӵ����ʵ���Ϊ ��
�� ��һ�����ӷ���ʽ��ʾ�÷�Ӧ ��
��1���ڶ����ڢ�A�壨1�֣�
��2�� ��1�֣� ���Ӽ���1�֣�
��1�֣� ���Ӽ���1�֣�
��3�� S2->O2->Na+ ��1�֣�
��4���� ���ᣨHNO3����1�֣� ����NaHCO3��Һ��1�֣�ȱ�١����͡������֣�
�� SiO2- 3+CO2+H2O=H2SiO3��+CO2- 3 (дH4SiO4Ҳ���֣���1�֣�
�� ̼�͵�Ԫ�ش���ͬһ���ڣ���ԭ�ӵ��˵��������̼ԭ�ӣ�ԭ�Ӱ뾶��̼ԭ��С����ԭ�Ӻ˶��������ӵ������������õ���������ǿ����˵�Ԫ�صķǽ�����ǿ��̼Ԫ�ء� ��2�֣�
��5����0.5 mol ��1�֣�
��10Na2O2 + 6Al3+ + 6H2O = 4Al(OH)3 + 2AlO��2+ 5O2��+ 20Na+ ��2�֣�
������������������������=�����������������=����������-8��F��O�����ۣ������ԭ��������֪��A��C��B��N��C��O��D��Na��E��Al��F��Si��G��S��
��1��Cλ�ڵڶ����ڢ�A��
��2��Na2S���γɹ��� ���������Ӽ���
���������Ӽ���
��3�� S2-��3�����Ӳ㣬O2-��Na+ֻ��2�����Ӳ㣨���Ӳ�ṹ��ͬ������Խ�뾶ԽС����
���ԣ�S2->O2->Na+ ��
��4���ǽ�����ǿ��������������ˮ���������ǿ���йأ�C��N��Si������������ˮ����ֱ�ΪH2CO3��HNO3��H2SiO3��������Һ��һ����ѭǿ���������ԭ����������ҺaΪHNO3������aΪNa2CO3����ҺbΪ����NaHCO3��Һ�����ڳ�ȥCO2�е�HNO3����ҺcΪNa2SiO3��
��5���ٵ���ת�Ʒ�����Na2O2�е�O��ÿ��Na2O2ת��1�����ӣ�����0.5 mol Na2O2ת�Ƶ���0.5 mol��
�ڷ�ӦΪ��10Na2O2 + 6Al3+ + 6H2O = 4Al(OH)3 + 2AlO��2+ 5O2��+ 20Na+
���㣺���Ԫ���ƶϿ���Ԫ�����ڱ����ɣ�������ʽ����ѧ����Ԫ�ؼ��仯����֪ʶ��������ԭ֪ʶ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ͼΪ�ġ��塢����������Ԫ�ؼ��⻯��е������ڱ仯ͼ�������⻯A��B��C��D��������һ��Ԫ�أ�����ͼ�ش�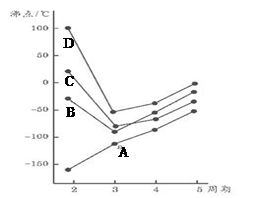
��1��д��B3���Ŀռ乹��
��2��BԪ������һ���⻯����������ȼ�ϣ������ʽΪ��__________________������ԭ���ӻ���ʽΪ_______________
��3��AԪ�������ᄃ������Ϊ____________________���о������������ᄃ���У�A��λ������ʯ������̼ԭ��λ�����ƣ��Է���������ռ����ԭ�Ӹ���ӦΪ___________����
��4��A��B��C��D��һ��������С�����˳����____________________����Ԫ�ط��ű�ʾ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ԭ���������������A��B��C��D��E��F���ֶ�����Ԫ�أ�AԪ�ص�ԭ�Ӱ뾶������Ԫ����ԭ����С�ģ�CԪ�ص�����������Ӧˮ���������⻯����������M��E��Aͬ���壬����Eͬ���ڣ�FԪ��ԭ�ӵ������������ȴ�����������2��A��B��C��E��F������Ԫ�أ�ÿ������DԪ�ض����γ�ԭ�Ӹ����Ȳ���ͬ�������ֻ������ش�
��1��DԪ�������ڱ��е�λ��Ϊ______________��
��2�����ԱȽ�D��F�õ�������ǿ������___________________����д��ţ���
a���Ƚ�������Ԫ��ԭ�Ӱ뾶�Ĵ�С
b�������γɵĻ������У�DԪ�ص�ԭ���Ը���
c���Ƚ�������Ԫ�ص���̬�⻯����ȶ���
��3����M�к��еĻ�ѧ��������______________________����д�����������ӵĵ���ʽ_________________��
��4����֪1molE��ˮ��Ӧ�ų�283.5kJ����������д��E��ˮ��Ӧ���Ȼ�ѧ��Ӧ����ʽ
________________________________________________________________��
��5������������ȼ�ϵ��(SOFC)�Թ�����������Ϊ����ʡ��乤��ԭ������ͼ��ʾ��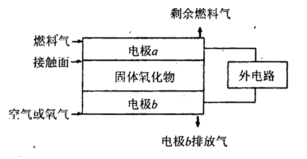
�ٹ����������е�O2����_________����������������ƶ���
�ڵ缫bΪ���_________������缫��ӦʽΪ______________________________��
����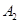 ��Ϊȼ��������Ӵ����Ϸ����ķ�ӦΪ______________________________��
��Ϊȼ��������Ӵ����Ϸ����ķ�ӦΪ______________________________��
����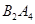 ��Ϊȼ��������Ӵ����Ϸ����ķ�ӦΪ________________________________��
��Ϊȼ��������Ӵ����Ϸ����ķ�ӦΪ________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
A��B��C��D��EΪǰ��������ԭ���������������Ԫ�أ���ص���Ϣ���£�
| Ԫ�� | �����Ϣ |
| A | AԪ��ԭ�Ӻ���ֻ�������ܼ�����ÿ���ܼ��Ϻ�����ȵĵ����� |
| B | �ǿ����к�����ḻ��Ԫ�� |
| C | �������У�����C�Ľ�������ǿ |
| D | ��̬ԭ�ӵ����ܲ�����7���˶�״̬��ͬ�ĵ��� |
| E | һ�ֺ��ص�������Ϊ63��������Ϊ34 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
A��B��C��D��E��F��Ԫ�����ڱ�ǰ�����ڵ�����Ԫ�أ�ԭ���������������������Ϣ���±���
| Ԫ�� | �����Ϣ |
| A | ԭ�ӵĺ���������͵��Ӳ������ |
| B | ��̬ԭ�Ӽ۵����Ų�Ϊnsnnpn |
| C | ��̬�⻯��������������ˮ���ﷴӦ������ |
| D | ��̬ԭ�ӵ����Ų���2��δ�ɶԵ��� |
| E | λ�ڵ������ڣ���ͬ������ԭ�Ӱ뾶��� |
| F | ��B �γɵĺϽ�ΪĿǰ�������Ľ������� |
 2CA3��H��0����Ӧ10min�ﵽƽ�⣬����0.2molCA3��
2CA3��H��0����Ӧ10min�ﵽƽ�⣬����0.2molCA3���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
X��Y��Z��W��Ԫ�����ڱ�ǰ�����ڳ���������Ԫ�أ�ԭ��������������X�ĵ��ʼ��ЦҼ��V�Цм�����X�ĵ�һ�����ܱ�������Ԫ�ض���Y�ĵ縺�Ա�X��С�����̬ԭ��������p�����Ǹò�s���ӵ�������Z��ǰ36��Ԫ����ԭ�Ӱ뾶��������Ԫ�أ�W��һ�ֺ��ص���������56����������30��
(1) Yλ��Ԫ�����ڱ���_______���ڵ�_______�壬W2+�ĺ�������Ų�ʽ��______��
(2) X��������XO2��H2O�Ƚϣ��۵�ϸߵ���_______ (�ѧʽ)��Z���⻯������ ���壬Z2O2�Ļ�ѧ��������_______(���ţ�
| A�����Ӽ� | B�����Թ��ۼ� | C���Ǽ��Թ��ۼ� | D�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
����������������10��1�յ�Լ19ʱ26�֣��϶���������ɹ����䡣����Щʱ������������9ʱ�𣬹�����Ա��ʼΪ���϶���š��ͳ����������ע����ȼ�ϣ���14ʱ30�����Ҽ�ע����ȼ�ռ����˺���18ʱ���Ҽ�ע��������

�ף��϶���ŷ���˲�� �ң������е��϶����
��֪A��B��C��D��Ԫ�����ڱ��е����ֶ�����Ԫ�أ���ԭ��������������A�ĵ��������������еġ�ȼ�ռ�����C�ĵ��������������еġ�����������AԪ��ԭ����û�����ӣ�bB��cC����Ԫ�ش��ڹ�ϵ��b = c��1��CԪ�س������ϼ۵ľ���ֵ����������������ͬ����B��C���γɶ�����̬���������һ�ֿ����ڴ���Ȼ״̬���γɣ�A��D����Ԫ���γɵ�˫ԭ�ӷ��ӵ�ˮ��Һ�ǹ�ҵ����ǿ��֮һ��
�����������⣺
��1��AԪ����Ԫ�����ڱ��� ���У�DԪ����Ԫ�����ڱ��� �����С�
��2��Bԭ�ӵ�ԭ�ӽṹʾ��ͼ�� ��
��3��A��B����Ԫ���γɵ���ԭ�ӷ��ӵĵ���ʽΪ ��
��4����ͼ���з�����Ӧ�Ļ�ѧ����ʽΪ�� ��
��5��A��B�γɵ���ԭ�ӷ���BA2��BA2Ҳ������Ϊ��������е�ȼ�ռ�����ʱ����ʹ��A��C�γɵ���ԭ�ӷ��ӣ�A2C2����Ϊ����������֪8g BA2��BA2������A2C2��Ӧ���������Ϊ�����壬�ų�����Ϊ160.35kJ��
��д��������Ӧ���Ȼ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�±���Ԫ�����ڱ�ǰ�����ڵ�һ���֣�X��Y��Z��R��W��J��6��Ԫ�صĴ��š�
| X | Y | Z | |
| | R | | |
| | | W | |
| | | | J |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ʴ���
�����ʽṹ�����ʡ�
��֪A��B��C��D��E����Ԫ�����ڱ���ǰ36�ŵ�Ԫ�أ����ǵ�ԭ��������������Aԭ�ӻ�̬ʱ���������������ڲ����������2����Bԭ�ӻ�̬ʱs��������P��������ȣ�C��Ԫ�����ڱ��ĸ�Ԫ���е縺�����D�Ļ�̬ԭ�Ӻ�����6���ܼ���ȫ���������ӣ�Eԭ�ӻ�̬ʱδ�ɶԵ�������ͬ����Ԫ�������ġ�
��1����̬Eԭ�ӵļ۵����Ų�ʽΪ ��
��2��AB32-�����幹���� ������Aԭ�ӵ��ӻ���������� ��
��3��A22-��B22+��Ϊ�ȵ����壬B22+�ĵ���ʽ�ɱ�ʾΪ ��1mol B22+�к��еĦм���ĿΪ ��
��4���������ʾʽд��C���⻯��ˮ��Һ�д��ڵ�������� ��
��5��������DC2�ľ����ṹ��ͼ��ʾ�������ӻ���Э������ܶ�Ϊa g/cm3����������� ��ֻҪ������ʽ�������ӵ�������ֵΪNA��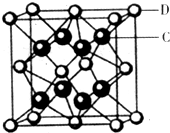
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com