
| n(MnO2) |
| n(Fe) |
| n(MnO2) |
| n(Fe) |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

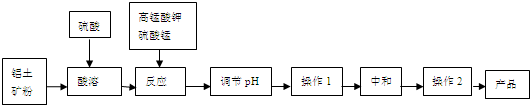
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
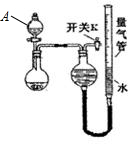
| 实验 | 药品 | 制取气体 | 量气管中液体 |
| Ⅰ | Cu,稀HNO3 | NO | H2O |
| Ⅱ | NaOH(s),浓氨水 | NH3 | |
| Ⅲ | 镁铝合金、NaOH溶液 | H2 | H2O |

| 编号 | 镁铝合金度量 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 1.0g | 10.0mL | 346.3mL |
| ② | 1.0g | 10.0mL | 335.0mL |
| ③ | 1.0g | 10.0mL | 345.7mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
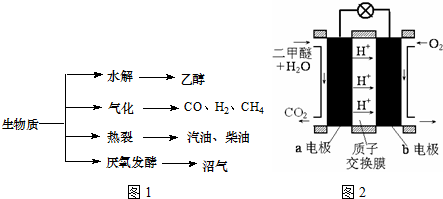
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molCO、2molH2 | 1mol CH3OH | 2molCO、4molH2 |
| CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 放出Q1 kJ | 吸收Q2 kJ | 放出Q3 kJ |
| 反应物转化率 | α 1 | α 2 | α 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
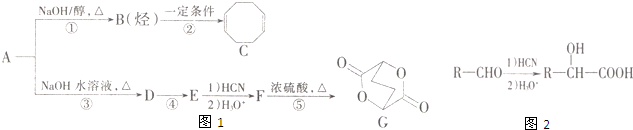
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓氨水可检验氯气管道泄漏 |
| B、明矾可用作除去污水中悬浮颗粒的絮凝剂 |
| C、Si和SiO2都用于制造光导纤维 |
| D、硬铝、青铜和不锈钢都属合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)某学习小组用0.80mol/L标准浓度的烧碱溶液测定未知浓度的盐酸.
(1)某学习小组用0.80mol/L标准浓度的烧碱溶液测定未知浓度的盐酸.| 实验编号 | 待测HCl溶液的体积(mL) | 滴入NaOH溶液的体积(mL) |
| 1 | 20.00 | 23.00 |
| 2 | 20.00 | 23.10 |
| 3 | 20.00 | 22.90 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com