
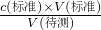 分析,c(待测)偏大;在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,蒸馏水不影待测液的量,对V(标准)无影响,c(待测)═
分析,c(待测)偏大;在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,蒸馏水不影待测液的量,对V(标准)无影响,c(待测)═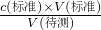 分析,c(待测)不变;故答案为:偏大;无影响.
分析,c(待测)不变;故答案为:偏大;无影响. 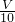 amol?L-1,100.00mL水溶液中H2C2O4的物质的量为
amol?L-1,100.00mL水溶液中H2C2O4的物质的量为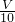 amol?L-1×0.1L=
amol?L-1×0.1L=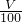 amol,H2C2O4?5H2O的质量为:
amol,H2C2O4?5H2O的质量为: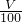 amol×180g/mol=
amol×180g/mol=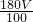 ag,该样品中草酸晶体的纯度为
ag,该样品中草酸晶体的纯度为 ×100%=
×100%=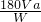 %,故答案为:
%,故答案为: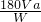 %,
%,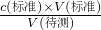 分析误差;
分析误差;

科目:高中化学 来源: 题型:阅读理解
| 180Va |
| W |
| 180Va |
| W |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 50w |
| 9av |
| 50w |
| 9av |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 草酸晶体的组成可用H2C2O4?xH2O表示,为了测定x值,进行如下实验:
草酸晶体的组成可用H2C2O4?xH2O表示,为了测定x值,进行如下实验:| V |
| 10 |
| V |
| 10 |
查看答案和解析>>
科目:高中化学 来源:2013届贵州省湄潭中学高三上学期期末考试化学试卷(带解析) 题型:实验题
(16分)乙二酸(HOOC-COOH)俗名草酸,易溶于水,属于二元中强酸,生产和科学实验中有着广泛的用途。草酸晶体的组成可用H2C2O4·xH2O表示,为了测定x值,进行如下实验:称取Wg草酸晶体,配成100.00mL水溶液,量取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为amol·L-1的KMnO4溶液滴定,
(1)将所发生的反应方程式完成并配平,将完整的化学方程式写在答题卡上。 KMnO4 + H2C2O4 + ( )---K2SO4 + CO2↑+ MnSO4 + ( )
KMnO4 + H2C2O4 + ( )---K2SO4 + CO2↑+ MnSO4 + ( )
(2)整个实验过程中不需要的仪器有 (填序号)。
a.托盘天平(带砝码,镊子)b.酸式滴定管 c.烧瓶
d.100mL容量瓶 e.烧杯 f.漏斗 g.锥形瓶
h.玻璃棒 i.药匙
(3)实验中,标准KMnO4溶液应盛装在____式滴定管中。滴定终点时溶液的
颜色变化为 。
(4)在滴定过程中若用去amol·L-1的KMnO4溶液VmL,则所配制的草酸溶液的物质的量浓度为________mol·L-1,由此可计算x的值是___________。
(用含W、a、V的代数式表示)
(5)该小组同学将0.02mol草酸晶体(H2C2O4·2H2O)加入到100mL0.2mol/L的NaOH溶液中充分反应,测得反应后溶液呈酸性,则该溶液中各离子浓度由大到小的顺序为
查看答案和解析>>
科目:高中化学 来源:09-10年江西白鹭洲中学高二下学期期末试题 题型:实验题
(13分):草酸晶体的组成可用H2C2O4·xH2O表示,为了测定x值,进行如下实验:
称取Wg草酸晶体,配成100.00mL水溶液
(1)量取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为amol·L-1的KMnO4溶液滴定到KMnO4不再褪色为止,所发生的反应
2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O
试回答:(1)实验中不需要的仪器有(填序号)___________,还缺少的仪器有(填名称)___________________________________________________。
a.托盘天平(带砝码,镊子)b.滴定管 c.100mL量筒 d.100mL容量瓶 e.烧杯 f.漏斗 g.锥形瓶 h.玻璃棒 i.药匙 j.烧瓶
(2)实验中,标准液KMnO4溶液应装在_____式滴定管中,因为____ ___________。
(3)若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,则所测得的x值会__________________________(偏大、偏小、无影响)
(4)在滴定过程中若用amol·L-1的KMnO4溶液VmL,则所配制的草酸溶液的物质的量浓度为________________________mol·L-1,由此可计算x的值是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com