
分析 (1)二氧化氮易溶于水,它溶于水后生成硝酸和一氧化氮;
(2)①氨气可以把NO2、NO还原成无色无毒气体氮气;
②实验室用加热铵盐和碱的固体混合物制取氨气;
(3)2NO2+2NaOH═NaNO2+NaNO3+H2O,NO+NO2+2NaOH═2NaNO2+H2O,根据气体完全被吸收时,NO不能剩余即可;
(4)①根据n=CV求出所需的氢氧化钠的物质的量,然后根据质量m=nM求出所需的质量,据此分析计算;
②根据c=$\frac{n}{V}$分析操作对溶质的物质的量或对溶液的体积的影响判断;
(5)红热的炭与浓硝酸加热反应生成二氧化氮和二氧化碳、水.
解答 解:(1)二氧化氮气体易与水反应生成硝酸(HN03)和一氧化氮,化学方程式为:3NO2+H2O=2HNO3+NO,
故答案为:3NO2+H2O=2HNO3+NO;
(2)①氨气可以把NO还原成无色无毒气体氮气,反应方程式为:6NO+4NH3$\frac{\underline{\;催化剂\;}}{\;}$5N2+6H2O,
故答案为:6NO+4NH3$\frac{\underline{\;催化剂\;}}{\;}$5N2+6H2O;
②实验室用加热氯化氨和消石灰的固体混合物制取氨气,反应方程式为:2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(3)2NO2+2NaOH═NaNO2+NaNO3+H2O,NO+NO2+2NaOH═2NaNO2+H2O,根据第二个反应,a=b即可,根据第一个反应需要a大于b,所以a≥b,
故答案为:a≥b;
(4)①配制0.1mol•L-1NaOH溶液500mL所需的氢氧化钠的物质的量n=CV=0.1mol/L×0.5L=0.05mol,质量m=nM=0.05mol×40g/mol=2.0g,
故答案为:2.0;
②A.将稀释的NaOH溶液转移至容量瓶后,未洗涤烧杯和玻璃棒,溶质的物质的量偏小,溶液的浓度偏低,故A选;
B.稀释后没冷却到室温就将溶液转移至容量瓶,冷却后,液面下降,溶液的体积偏小,溶液的浓度偏高,故B不选;
C.用胶头滴管向容量瓶中加水定容时,溶液凹液面高于容量瓶刻度线,此时立即用胶头滴管将瓶内液体吸出,使溶液凹液面与刻度线相切,吸出的溶液中含有溶质,导致溶质的物质的量偏小,溶液的浓度偏低,故C选;
D.用胶头滴管加水定容时.俯视观察溶液凹液面与容量瓶刻度线相切,导致配制的溶液的体积偏小,浓度偏高,故D不选;
E.移液时容量瓶中有少量蒸馏水,定容时需加水,所以对溶液体积无影响,则对溶液浓度无影响,故E不选;
故答案为:AC;
(5)红棕色的气体为二氧化氮,红热的炭与浓硝酸加热反应生成二氧化氮和二氧化碳、水,化学方程式为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,
故答案为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
点评 本题考查学生含氮化合物、含硫化合物的性质以及应用知识,注意知识的归纳和梳理是解题的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ae | B. | aef | C. | abc | D. | ac |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/LHA溶液的pH=3.5 | |
| B. | 0.1mol/LHA溶液中,由HA电离出的c(H+)约为水电离出的c(H+)的106倍 | |
| C. | 0.1mol/LNaA溶液中,各离子浓度大小顺序为:c(Na+)>c(OH-)>c(A-)>c(H+) | |
| D. | 向0.1mol/LNaA溶液中加水稀释,所有离子浓度均降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18gD2O和18gH2O中含有的质子数均为10NA | |
| B. | 2L0.5mol/L亚硫酸溶液中含有的氢离子数为2NA | |
| C. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA | |
| D. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1醋酸溶液中含有醋酸分子的数目为0.1NA | |
| B. | 25℃时,1 L pH=12的Na2CO3溶液中含有Na+的数目为0.2 NA | |
| C. | 常温下,20 L pH=12的Na2CO3溶液中含有OH-数目为0.2 NA | |
| D. | 某密闭容器盛有0.1 mol N2和0.3 mol H2,在一定条件下充分反应,转移电子数目为0.6 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是( )
在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是( )| A. | 该反应进行到M点放出的热量大于进行到W点放出的热量 | |
| B. | T2下,在0~t1时间内,v(Y)=$\frac{a-b}{{t}_{1}}$ mol•L-1•min-1 | |
| C. | M点的正反应速率v正大于N点的逆反应速率v逆 | |
| D. | M点的正反应速率小于W点的逆反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
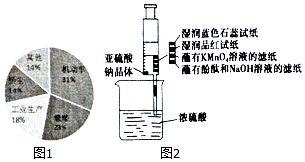 晋中市气象台2017年1月7日11时35分发布了雾霾黄色预警,随后晋中市发布了机动车限行通告.通过调查发现,形成雾霾的污染来源如图1所示.主要是机动车排放物和燃煤废气,其中会有大量的NOx和SO2.
晋中市气象台2017年1月7日11时35分发布了雾霾黄色预警,随后晋中市发布了机动车限行通告.通过调查发现,形成雾霾的污染来源如图1所示.主要是机动车排放物和燃煤废气,其中会有大量的NOx和SO2.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com