
| A. | Fe→FeCl2 | B. | CuO→Cu | C. | Cl2→HCl | D. | SO3→H2SO4 |
科目:高中化学 来源: 题型:填空题
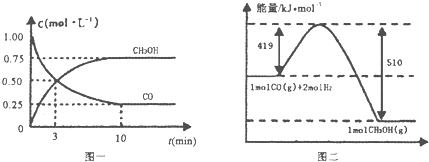
| 容器 | 反应物投入的量 | 反应物的转化率 | CH3OH的浓度 | 能量变化 (Q1,Q2,Q3均大于0) |
| 甲 | 1mol CO和2mol H2 | a1 | c1 | 放出Q1kJ热量 |
| 乙 | 1mol CH3OH | a2 | c2 | 吸收Q2kJ热量 |
| 丙 | 2mol CO和4mol H2 | a3 | c3 | 放出Q3kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮原子的质量就是氮的相对原子质量 | |
| B. | 氦气的摩尔质量是8g•mol-1 | |
| C. | 1molH2SO4中含1molH2 | |
| D. | 1molH2O的质量是18g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
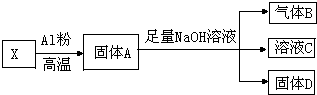 某同学设计实验将Fe3O4和CuO组成的混合物X进行如图所示的转化(每一步均反应完全)
某同学设计实验将Fe3O4和CuO组成的混合物X进行如图所示的转化(每一步均反应完全)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
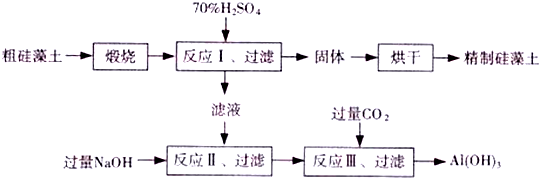
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
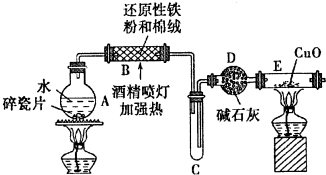
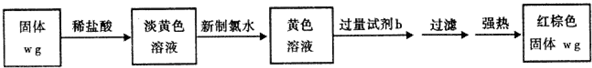
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
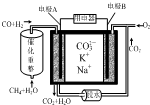
| A. | 电极A为正极,发生了还原反应 | |
| B. | 电极A上CO参与的电极反应为:CO+O2--2e-═CO2 | |
| C. | 电极B上发生的电极反应为:O2+2CO2+4e-═2CO32- | |
| D. | 电池工作时,K+向电极A移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
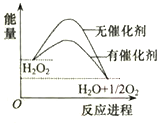
| A. | 元素O的单质存在O2和O3两种同位素 | |
| B. | 加入催化剂,减小了H2O2分解反应的热效应 | |
| C. | 若H2O2分解产生1molO2,理论上转移4mol电子 | |
| D. | H2O2和Na2O2所含化学键类型不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 小苏打溶液中滴加足量澄清石灰水:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| B. | Fe3O4溶于足量的稀盐酸:Fe3O4+8H+═2Fe3++Fe2++4H2O | |
| C. | 将少量的SO2气体通入NaClO溶液中:SO2+H2O+ClO-═SO42-+Cl-+2H+ | |
| D. | 向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:Ba2++2OH-+H++SO42-+NH4+═BaSO4↓+NH3•H2O+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com