
【题目】某学校化学学习小组为探究二氧化氮的性质,按下图所示装置进行实验。
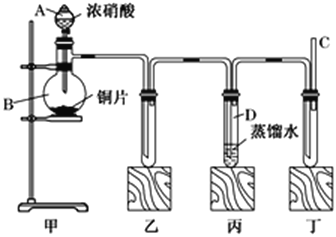
(1)装置甲中发生反应的化学方程式为________________________。
(2)装置丙中的试管内发生反应的离子方程式为:_______________________。
(3)为了探究NO的还原性,可以在装置丁的导气管C中通入一种气体,通入的这种气体的名称是________。
(4)取下装置丙中的试管D,在其中滴加FeSO4溶液,溶液变为________色,为了证明铁元素在该反应中的产物,可以再在溶液中滴加NH4SCN溶液,用离子方程式表示检验原理___________。
(5)硝酸厂常用催化还原方法处理尾气。CH4在催化条件下可以将NO2还原为N2。
已知:CH4(g)+2O2(g)===CO2(g)+2H2O(g)ΔH=-889.6 kJ·mol-1①
N2(g)+2O2(g)===2NO2(g)ΔH=+67.7 kJ·mol-1②
则CH4还原NO2生成水蒸气和氮气的热化学方程式是_____________。
【答案】Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O3NO2+H2O===2H++2NO![]() +NO氧气红(或“血红”)Fe3++3
+NO氧气红(或“血红”)Fe3++3![]()
![]() Fe(SCN)3CH4(g)+2NO2(g)===N2(g)+2H2O(g)+CO2(g) ΔH=-957.3 kJ·mol-1
Fe(SCN)3CH4(g)+2NO2(g)===N2(g)+2H2O(g)+CO2(g) ΔH=-957.3 kJ·mol-1
【解析】
(1)装置甲中浓硝酸与铜反应生成硝酸铜、二氧化氮和水,发生反应的化学方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;(2)装置丙中的试管内二氧化氮与水反应生成硝酸和一氧化氮,发生反应的离子方程式为3NO2+H2O=2H++2NO3-+NO;(3)一氧化氮被氧气氧化表现还原性,被氧化为二氧化氮,故可以在装置丁的导气管C中通入一种气体,通入的这种气体的名称是氧气;(4)试管D中的溶液为稀硝酸,稀硝酸具有氧化性,能够将亚铁离子氧化为铁离子,铁离子与SCN-生成血红色的物质;用离子方程式表示检验原理为Fe3++3![]()
![]() Fe(SCN)3;(5)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=-889.6 kJ·mol-1①
Fe(SCN)3;(5)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=-889.6 kJ·mol-1①
N2(g)+2O2(g)=2NO2(g)ΔH=+67.7 kJ·mol-1②,根据盖斯定律,由①-②得反应CH4(g)+2NO2(g)=N2(g)+2H2O(g)+CO2(g) ΔH=-889.6 kJ·mol-1-67.7 kJ·mol-1=-957.3 kJ·mol-1.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列离子可以在指定溶液中大量共存的是( )
A.强酸性溶液中:Mg2+、SO42-、Na+B.久置氯水中:K+、CO32-、Ag+
C.无色溶液中:SO42-、MnO4-、Fe3+D.强碱性溶液中:OH-、Cu2+、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机物在酸性催化条件下发生水解反应, 生成两种不同的有机物, 且这两种有机物的相对分子质量相等, 该有机物可能是
A.蔗糖B.麦芽糖C.乙酸乙酯D.甲酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期主族元素原子半径与原子序数的关系图。下列说法正确的是
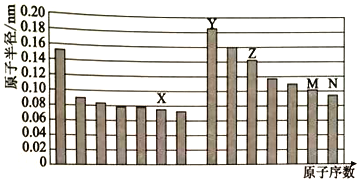
A. Z、N两种元素的离子半径相比,前者大
B. X、N两种元素的氢化物的沸点相比,前者较低
C. M比X的原子序数多7
D. Z单质均能溶解于Y的氢氧化物和N的氢化物的水溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素A、B、C、D、E、G的原子序数依次增大,在元素周期表中A的原子半径最小(稀有气体元素除外),B与C相邻且C的最外层电子数是次外层的3倍,C、D的最外层电子数之和与G的最外层电子数相等,E是地壳中含量最多的金属元素。回答下列问题:
(1)C在元素周期表中的位置是_________周期、_________族;G的元素符号是_________。
(2)B的原子结构示意图是_________;C与D组成的既含离子键又含共价键的化合物电子式是_________。
(3)E单质能与D的最高价氧化物的水化物浓溶液反应放出氢气,反应的化学方程式是__________________;由上述六种元素中的三种组成的某种盐,水溶液显碱性,将该盐溶液滴入硫酸酸化的KI淀粉溶液中,溶液变为蓝色,则反应的离子方程式是__________________。
(4)由A、B、C、E中的某些元素组成的化合物X、Y、Z、W有如下转化关系:
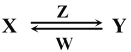
X、Y、Z、W中均由三种元素组成,Z是一种强酸,则Z的化学式是___________,Y溶液与过量W反应的离子方程式是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有科学家提出硅是“21世纪的能源”、“未来的石油”的观点。假如硅作为一种普遍使用的新型能源被开发利用,下列关于其有利因素的说法中,你认为不妥的是
A. 便于运输、储存,从安全角度考虑,硅是最佳的燃料
B. 自然界的含硅化合物易开采
C. 硅燃烧放出的热量大,燃烧产物对环境污染程度低且容易有效控制
D. 自然界中存在大量单质硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+F2(g)![]() 2HF(g)+270kJ,下列说法正确的是( )
2HF(g)+270kJ,下列说法正确的是( )
A. 2L氟化氢气体分解成1L的氢气和1L的氟气吸收270kJ热量
B. 1mol氢气与1mol氟气反应生成2mol液态氟化氢放出的热量小于270kJ
C. 在相同条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量
D. 1个氢气分子与1个氟气分子反应生成2个氟化氢分子放出270kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g)![]() 3C(g)+4D(g)反应中,表示该反应速率最快的是( )
3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A. v(B)=0.3mol/(L· s) B. v(A)=0.5mol/(L· min)
C. v(C)=0.8mol/(L· s) D. v(D)=1mol/(L· min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛酸钡(BaTiO3)在工业上有重要用途,主要用于制作电子陶瓷、PTC热敏电阻、电容器等多种电子元件。以下是生产钛酸钡的一种工艺流程图:
![]()
已知:①草酸氧化钛钡晶体的化学式为BaTiO(C2O4)2·4H2O;
②25℃时,BaCO3的溶度积Ksp=2.58×10-9;
(1)BaTiO3中Ti元素的化合价为:__________。
(2)用盐酸酸浸时发生反应的离子方程式为: __________。
(3)流程中通过过滤得到草酸氧化钛钡晶体后,为提高产品质量需对晶体洗涤。
①过滤操作中使用的玻璃仪器有_____________________。
②如何证明晶体已洗净?_______________________。
(4)TiO2具有很好的散射性,是一种有重要用途的金属氧化物。工业上可用TiCl4水解来制备,制备时需加入大量的水,同时加热,其目的是:_______________。
(5)某兴趣小组取19.70gBaCO3模拟上述工艺流程制备BaTiO3,得产品13.98g,BaTiO3的产率为:________。
(6)流程中用盐酸酸浸,其实质是BaCO3溶解平衡的移动。若浸出液中c(Ba2+)=0.1mol/L,则c(CO32-)在浸出液中的最大浓度为__________ mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com