
����Ŀ��ij���Ͻ��к���Ԫ������þ��ͭ���裬Ϊ�˲ⶨ�úϽ������ĺ��������������ʵ�飬��ش��й����⣺
(1)��ȡ��Ʒa g(��ȷ��0.1 g)������ʱͨ��ʹ�õ���Ҫ������������_____��
(2)����Ʒ�ܽ��ڹ�����ϡ���ᣬ���˲�ϴ����������Һ����Ҫ����________������Ϊ________���ܽ⡢�����õ��IJ���������________��
(3)����Һ�мӹ���������������Һ�����˲�ϴ���������йص����ӷ���ʽ��________________________________________________________________��
(4)����(3)����Һ��ͨ�������Ķ�����̼���壬���˲�ϴ���������йص����ӷ���ʽ��______________________________________________________________��
(5)������(4)�����õ�������ɲ����������ء���ȴ�������������Ϊb g���йط�Ӧ�Ļ�ѧ����ʽ��
_______________________________________________________________________��ԭ��Ʒ����������������________��
���𰸡�������ƽHCl��MgCl2��AlCl3Cu��Si�ձ�����������©��Mg2����2OH��===Mg(OH)2����Al3����4OH��===AlO2-��2H2OOH����CO2===HCO3-��AlO��CO2��2H2O===Al(OH)3����HCO3-)2Al(OH)3![]() Al2O3��3H2O
Al2O3��3H2O![]()
��������
��1��ʹ��������ƽ��ȡ��Ʒ��������2����������Ӧ�����Ȼ�����Mg�����ᷴӦ�����Ȼ�þ�����ʹ��ͭ���ܹ���ϡ���ᷢ����Ӧ�������������У��ܽ⡢���˹�����Ҫ�����У��ձ���©��������������3��ʣ����������������Ʒ�Ӧ�����Ȼ�����ˮ���Ȼ�þ���������Ʒ�Ӧ����������þ�������Ȼ��ƣ��Ȼ�����������������Ʒ�Ӧ����ƫ���������Ȼ��ƣ���4������������̼��ƫ����������Ӧ������������������̼�����ƣ���5�����ó���Ϊ�������������ȷֽ�õ���������ˮ����������AlԪ��������Ϊ�Ͻ���Al����������������Al������������
(1)��ȡa g��Ʒʹ�õ���Ҫ����Ϊ������ƽ��(2)�Ͻ���Al��Mg�������ᷴӦ����AlCl3��MgCl2��H2����Cu��Si����������������Ʒ�����������˿ɵ�Cu��Si����Һ����Ҫ��HCl��AlCl3��MgCl2��(3)��(2)����Һ�мӹ���NaOH��Һ�������ķ�ӦΪMg2����2OH��===Mg(OH)2����Al3����4OH��===AlO��2H2O�����˺���Һ�к�AlO��OH����(4)��AlO��OH������Һ��ͨ������CO2�������ķ�ӦΪOH����CO2=== HCO��AlO��CO2��2H2O===Al(OH)3����HCO�����˿ɵ�Al(OH)3��(5)����b g����ΪAl2O3���ʺϽ��к�Al����������Ϊ![]() ��100%��
��100%��![]() %��
%��


 ���źþ���Ԫ����ĩ��ϵ�д�
���źþ���Ԫ����ĩ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Bilirubin��һ�������Ĺ������·����ֽⷴӦ����Ӧ��Ũ���淴Ӧʱ��仯����ͼ��ʾ�����㷴Ӧ4��8 min���ƽ����Ӧ���ʺ��ƲⷴӦ16 minʱ��Ӧ���Ũ�ȣ����Ӧ��( ����)
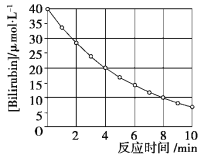
A.2.5 ��mol��L��1��min��1��2.0 ��mol��L��1
B.2.5 ��mol��L��1��min��1��2.5 ��mol��L��1
C.3.0 ��mol��L��1��min��1��3.0 ��mol��L��1
D.5.0 ��mol��L��1��min��1��3.0 ��mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������(AlP)ͨ������Ϊһ�ֹ�����Ѭ��ɱ�������ˮ������������߶���PH3����(�е�-89.7�棬��ԭ��ǿ)��ij��ѧ��ȤС���ͬѧ�����������ⶨ��ʳ�в�������ĺ�����

��C�м���100gԭ����E�м���20.00mL 1.50��l0-3mol/L KMnO4��Һ(H2SO4�ữ)����C�м�������ˮ����ַ�Ӧ�����������Ʊ���Һ�ζ�E�й�����KMnO4��Һ���ش���������:
(1)����D��������________________________��
(2)AlP��ˮ��Ӧ�Ļ�ѧ����ʽΪ__________________________________��
(3)װ��A��ʢװKMnO4��Һ�������dz�ȥ�����еĻ�ԭ�����壬װ��B��ʢ�н���ûʳ����( )�ļ�����Һ����������_____________________________��
)�ļ�����Һ����������_____________________________��
(4)ͨ�������������____________________________________��
(5)װ��E��PH3�����������ᣬ��װ��E�з�����Ӧ���������ͻ�ԭ�����ʵ���֮��Ϊ______________��(6)�ռ�װ��E�е�����Һ����ˮϡ����250mL��ȡ25.00mL����ƿ�У���4.0��10-4mol/L��Na2SO3����Һ�ζ�ʣ���KMnO4��Һ������Na2SO3����Һ15.00mL��Na2SO3��KMnO4��Һ��Ӧ�����ӷ���ʽΪ______________, ���ԭ��������(��PH3��)�ĺ���Ϊ_____ mg��kg-1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ж�����Ƭ��ʴ�Ա�ʵ��ķ�����ȷ���ǣ� ��
��� | �� | �� | �� |
ʵ�� |
|
|
|
���� | 8Сʱδ�۲� ��������ʴ | 8Сʱδ�۲� ��������ʴ | 1Сʱ�۲� ��������ʴ |
A.�Ա�ʵ��٢ڢۣ�˵�����ܸ���O2
B.ʵ����У�����Ƭδ��������ʴ����Ҫԭ����ȱ��O2
C.ʵ����У�NaCl��Һ���ܽ��O2������ʹ����Ƭ������ʴ
D.ʵ����У���������������ʴ��������Ӧ��O2+4e-+2H2O=4OH-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о�NO2��SO2��CO�ȴ�����Ⱦ����Ĵ���������Ҫ���塣
��1��NO2����ˮ���գ���Ӧ�Ļ�ѧ��Ӧ����ʽΪ_______�����÷�Ӧ6NO2��8NH3![]() 7N2��12H2OҲ�ɴ���NO2����ת��1.2mol����ʱ�����ĵ�NO2�ڱ�״������______L��
7N2��12H2OҲ�ɴ���NO2����ת��1.2mol����ʱ�����ĵ�NO2�ڱ�״������______L��
��2����֪��2SO2(g)+O2(g)![]() 2SO3(g) ��H1����196.6 kJmol-1
2SO3(g) ��H1����196.6 kJmol-1
2NO(g)+O2(g)![]() 2NO2(g) ��H2����113.0kJmol-1
2NO2(g) ��H2����113.0kJmol-1
��ӦNO2(g)+ SO2(g)![]() SO3(g)+NO(g)����H=________kJmol-1��
SO3(g)+NO(g)����H=________kJmol-1��
һ�������£���2molNO2��2molSO2�����ݻ��̶��ĺ����ܱ������з���������Ӧ��������˵����Ӧ�ﵽƽ��״̬����__________������ĸ��
a����������ܶȱ��ֲ���
b�����������ɫ���ֲ���
c��SO3��NO������ȱ��ֲ���
d��ÿ����1molSO3��ͬʱ����1molNO2
�÷�Ӧ��ƽ��״̬�����������������1molNO2��1molSO2����SO2��ת���ʽ�_______���������С�����䡱����
��3��CO�����ںϳɼ״�����Ӧ����ʽΪCO(g)+2H2(g)![]() CH3OH(g) ��H����a kJmol-1����һ���¶��£���1molCO(g)��2molH2(g)���뵽���Ϊ10L���ܱ������У�������Ӧ������5min�ﵽƽ��,��ʱ������ѹǿΪ��Ӧǰ��0.8������v��CH3OH��Ϊ_______������Ӧ�ų�������Ϊ______��
CH3OH(g) ��H����a kJmol-1����һ���¶��£���1molCO(g)��2molH2(g)���뵽���Ϊ10L���ܱ������У�������Ӧ������5min�ﵽƽ��,��ʱ������ѹǿΪ��Ӧǰ��0.8������v��CH3OH��Ϊ_______������Ӧ�ų�������Ϊ______��
��4����֪N2O4(g)![]() 2NO2(g) ��H��0���ֽ�1molN2O4����һ��ѹ�ܱ������У�����ʾ��ͼ��˵����Ӧ�ﵽƽ��״̬����_______��
2NO2(g) ��H��0���ֽ�1molN2O4����һ��ѹ�ܱ������У�����ʾ��ͼ��˵����Ӧ�ﵽƽ��״̬����_______��
A�� B��
B�� C��
C��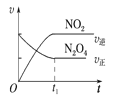 D��
D��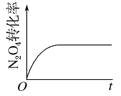
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾװ�ÿ�������ȡ�۲������������ڿ����б�����ʱ��ɫ�ı仯��ʵ��ʱ����ʹ����м��6 mol��L��1�����ᣬ�����Լ���ѡ��
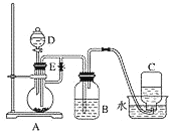
(1)B��ʢһ����������������Һ��A��ӦԤ�ȼ�����Լ���________��A�з�Ӧ�����ӷ���ʽ��_________��
(2)ʵ�鿪ʼʱ���Ƚ�ֹˮ��E________(�������������ر���)��C���ռ����������Ҫ�ɷ���________��
(3)�������������������IJ������̣�__________________��
(4)��ȥװ��B�е���Ƥ����ʹ�������룬�йط�Ӧ�Ļ�ѧ����ʽ��_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��N2O��CO�ǻ�����Ⱦ�����壬����Pt2O+ ����ת��Ϊ�����壬�䷴Ӧԭ��ΪN2O(g) + CO(g)![]() CO2(g) + N2(g) ��H���йػ�ѧ��Ӧ�����ʱ仯���̼������仯�������¡�����˵������ȷ����
CO2(g) + N2(g) ��H���йػ�ѧ��Ӧ�����ʱ仯���̼������仯�������¡�����˵������ȷ����
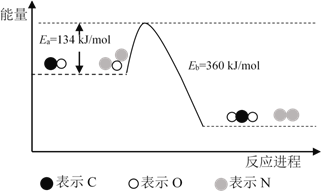
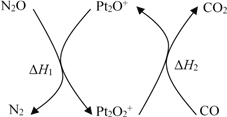
A. ��H = ��H1 + ��H2
B. ��H = 226 kJ/mol
C. �÷�Ӧ����Ӧ�Ļ��С���淴Ӧ�Ļ��
D. Ϊ��ʵ��ת���費����Ӧ���в��� Pt2O+ �� Pt2O2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���α�����ܵĺϳɰ������й��������ǵ¹�ŵ������ѧ������߹��������ġ���ϳ�ԭ��Ϊ��N2(g) + 3H2(g) ![]() 2NH3(g) ��H<0����S <0��
2NH3(g) ��H<0����S <0��
��1�����й��ڹ�ҵ�ϳɰ���˵������ȷ����_______
A����Ϊ��H<0�����Ը÷�Ӧһ�����Է�����
B����Ϊ��S<0�����Ը÷�Ӧһ�������Է�����
C���ڸ����½�����Ϊ����߷�Ӧ���ת����
D��ʹ�ô����ӿ췴Ӧ��������Ϊ���������˷�Ӧ����H
��2���ں��º����ܱ������н��кϳɰ��ķ�Ӧ��������˵���÷�Ӧ�Ѵﵽƽ��״̬����_______
a.������N2��H2��NH3��Ũ��֮��Ϊ1��3��2 b.v��(N2)= v��(H2)
c.������ѹǿ���ֲ��� d.��������ܶȱ��ֲ���
��3��ij����С���о����������������������£��ı���ʼ�����������ʵ����Թ�ҵ�ϳɰ���Ӧ��Ӱ�졣ʵ������ͼ��ʾ��ͼ��T��ʾ�¶ȣ�n��ʾH2���ʵ�������
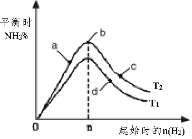
��ͼ����T2��T1�Ĺ�ϵ�ǣ�T2 __________T1������>��<��=������ͬ��
��a��b��c��d�ĵ�������ƽ��״̬�У���Ӧ��N2 ��ת������ߵ���______������ĸ����
��4�������£���һ��4L���ܱ������г���5.2mol H2��2mol N2����Ӧ�����ж�NH3��Ũ�Ƚ��м�⣬�õ����������±���ʾ��
ʱ��/min | 5 | 10 | 15 | 20 | 25 | 30 |
c(NH3)/mol��L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
�ٴ������¸÷�Ӧ�Ļ�ѧƽ�ⳣ��K=___________��
����ά������������䣬�¶Ȳ��䣬��ԭƽ����ϵ�м���H2��N2��NH3��4mol����ѧƽ�⽫��_______��Ӧ�����ƶ�����������桱����
��N2(g)+3H2(g) ![]() 2NH3(g)��H= -92kJ/mol���ں��º��ݵ��ܱ������г���1mol N2��һ������H2������Ӧ���ﵽƽ���÷�Ӧ�ų�������Ϊ18.4 kJ�������������ʵ���Ϊ3.6 mol�������ڵ�ѹǿ��Ϊԭ����90��������ʼʱ�����H2�����ʵ���Ϊ______mol��
2NH3(g)��H= -92kJ/mol���ں��º��ݵ��ܱ������г���1mol N2��һ������H2������Ӧ���ﵽƽ���÷�Ӧ�ų�������Ϊ18.4 kJ�������������ʵ���Ϊ3.6 mol�������ڵ�ѹǿ��Ϊԭ����90��������ʼʱ�����H2�����ʵ���Ϊ______mol��
��5����֪��N2(g)+3H2(g) ![]() 2NH3(g)��H= -92kJ/mol
2NH3(g)��H= -92kJ/mol
N2(g)+O2(g)��2NO(g) ��H= +181kJ/mol
2H2(g)+O2(g)��2H2O(g) ��H= -484kJ/mol
д����������������NO��ˮ�������Ȼ�ѧ����ʽ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڻ�ѧ��Ӧ���ʵ�˵���У�����ȷ���ǣ� ��
A.��ѧ��Ӧ�����Ǻ�����ѧ��Ӧ���п����̶ȵ�������
B.���ݻ�����ķ�Ӧ���У���ѧ��Ӧ����ͨ���õ�λʱ���ڷ�Ӧ��Ũ�ȵļ��ٻ�������Ũ�ȵ���������ʾ
C.��ij��ѧ��Ӧ�ķ�Ӧ����Ϊ![]() ������ָ�ڸ�ʱ���ڷ�Ӧ����������Ũ�ȱ仯��Ϊ
������ָ�ڸ�ʱ���ڷ�Ӧ����������Ũ�ȱ仯��Ϊ![]()
D.��ѧ��Ӧ�����ǿ���ͨ��ʵ��ⶨ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com