
已知反应①Fe(s)+CO2(g) FeO(s)+CO(g) ΔH=akJ·mol-1,平衡常数为K;
FeO(s)+CO(g) ΔH=akJ·mol-1,平衡常数为K;
反应②CO(g)+1/2O2(g) CO2(g) ΔH=bkJ·mol-1;
CO2(g) ΔH=bkJ·mol-1;
反应③Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) ΔH=ckJ·mol-1。测得在不同温度下,K值如下:
2Fe(s)+3CO2(g) ΔH=ckJ·mol-1。测得在不同温度下,K值如下:
温度/℃ | 500 | 700 | 900 |
K | 1.00 | 1.47 | 2.40 |
(1)若500 ℃时进行反应①,CO2的起始浓度为2 mol·L-1,CO的平衡浓度为 。(2)反应①为 (选填“吸热”或“放热”)反应。(3)700 ℃时反应①达到平衡状态,要使该平衡向右移动,其他条件不变时,可以采取的措施有 (填序号)。A.缩小反应器体积 B.通入CO2
C.温度升高到900 ℃ D.使用合适的催化剂
E.增加Fe的量
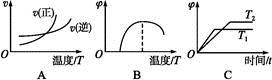
(4)下列图像符合反应①的是 (填序号)(图中v为速率,φ为混合物中CO含量,T为温度且T1>T2)。
(5)由反应①和②可求得,反应2Fe(s)+O2(g) 2FeO(s)的ΔH= 。
2FeO(s)的ΔH= 。
(6)请运用盖斯定律写出Fe(固体)被O2(气体)氧化得到Fe2O3(固体)的热化学方程式: 。
(1)1 mol·L-1 (2)吸热 (3)BC (4)A
(5)2(a+b) kJ·mol-1 (6)2Fe(s)+3/2O2(g) Fe2O3(s) ΔH=(3b-c) kJ·mol-1
Fe2O3(s) ΔH=(3b-c) kJ·mol-1
【解析】(1)(2)依据反应①,可写出该反应的化学平衡常数表达式K= ,从表中数据观察到:K值随温度升高而增大,说明正反应为吸热反应。在500 ℃时,假设CO2转化了x mol·L-1,达到平衡状态时,有下式成立:K=
,从表中数据观察到:K值随温度升高而增大,说明正反应为吸热反应。在500 ℃时,假设CO2转化了x mol·L-1,达到平衡状态时,有下式成立:K= =1.00,解得x=1,即平衡时CO的浓度为1 mol·L-1。
=1.00,解得x=1,即平衡时CO的浓度为1 mol·L-1。
(3)中,700 ℃时反应①达到平衡,要使该平衡向右移动,可以升高体系温度、增大反应物浓度(通入CO2),注意不要错选选项E,因为反应物Fe是固体,改变固体或纯液体的量对平衡无影响。
(4)中,图像A是温度改变对反应速率的影响,由于反应①的正反应是吸热反应,所以升高温度,正逆反应速率均增大,但正反应速率增大的幅度大,故A正确。图像B是温度改变对混合物中CO含量的影响,温度较低时反应不进行,随着温度升高混合物中CO的含量逐渐增大,不会减小,故B错误。图像C中T1>T2,温度升高平衡向右移动,则CO的含量高,故C错误。
(5)中,由反应①和②,进行如下处理:①+②,得到:
Fe(s)+O2(g) FeO(s) ΔH=(a+b) kJ·mol-1,
FeO(s) ΔH=(a+b) kJ·mol-1,
故反应2Fe(s)+O2(g) 2FeO(s)的ΔH=2(a+b) kJ·mol-1。
2FeO(s)的ΔH=2(a+b) kJ·mol-1。
(6)中,由反应③和②,进行如下处理:③-②×3,得到:
Fe2O3(s) 2Fe(s)+O2(g) ΔH=(c-3b) kJ·mol-1,
2Fe(s)+O2(g) ΔH=(c-3b) kJ·mol-1,
所以Fe固体被O2氧化得到Fe2O3固体的热化学方程式为:
2Fe(s)+O2(g) Fe2O3(s) ΔH=(3b-c) kJ·mol-1。
Fe2O3(s) ΔH=(3b-c) kJ·mol-1。


 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源:2014高考名师推荐化学常见仪器的使用(解析版) 题型:选择题
“封管实验”具有简易、方便、节约、绿色等优点,观察下列四个“封管实验”(夹持装置未画出),判断下列说法正确的是 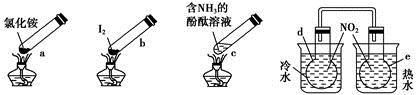
A.加热时,a上部聚集了固体NH4Cl,说明NH4Cl的热稳定性比较好
B.加热时,发现b中I2变为紫色蒸气,在上部又聚集为紫黑色的固体
C.加热时,c中溶液红色变深,冷却后又变浅
D.e内气体颜色变浅,d内气体颜色加深
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学实验专题(解析版) 题型:实验题
制备水杨酸对正辛基苯基酯( )如下:
)如下:
步骤一:将水杨酸晶体投入三颈烧瓶中,再加入氯苯,搅拌溶解后,加入无水三氯化铝。
步骤二:按图12所示装置装配好仪器,水浴加热控制温度在20~40℃之间,在搅拌下滴加SOCl2,反应制得水杨酰氯,该反应为:
 (水杨酸)+SOCl2→
(水杨酸)+SOCl2→ (水杨酰氯)+HCl↑+SO2↑
(水杨酰氯)+HCl↑+SO2↑

步骤三:将三颈烧瓶中的混合液升温至80℃,再加入对正辛苯酚( ),温度控制在100℃左右,不断搅拌。
),温度控制在100℃左右,不断搅拌。
步骤四:过滤、蒸馏、减压过滤;酒精洗涤、干燥。
(1)步骤一中加入三氯化铝的作用是 。
(2)实验时,冷凝管中的水应从 进 出(选填“a”或“b”);装置c的作用是 。
(3)步骤三??发生反应的化学方程式为 。
(4)步骤四减压过滤操作中,除烧杯、玻璃棒外,还必须使用的硅酸盐材料的仪器有 。
(5)步骤四减压过滤时,有时滤纸会穿孔,避免滤纸穿孔的措施是 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学基本营养物质(解析版) 题型:选择题
下列说法正确的是
A.乙烯和聚乙烯均能使溴水褪色
B.甲烷、苯和油脂均不能使酸性KMnO4溶液褪色
C.乙酸和乙酸乙酯均能发生取代反应
D.葡萄糖与果糖、淀粉与纤维素分子式相同,均互为同分异构体
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学周期表、核素(解析版) 题型:选择题
下列关于元素周期表的说法中正确的是
A.元素周期表有8个主族
B.ⅠA族的元素全部是金属元素
C.元素周期表有7个周期
D.短周期是指第1、2周期
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学可充电池的反应规律(解析版) 题型:选择题
一种光化学电池的结构如下图,当光照在表面涂有氯化银的银片上时, ,[Cl(AgCl)表示生成的氯原子吸附在氯化银表面],接着Cl(AgCl)+e-—→Cl-(aq),若将光源移除,电池会立即回复至初始状态。下列说法正确的是
,[Cl(AgCl)表示生成的氯原子吸附在氯化银表面],接着Cl(AgCl)+e-—→Cl-(aq),若将光源移除,电池会立即回复至初始状态。下列说法正确的是

A.光照时,电流由Y流向X
B.光照时,Pt电极发生的反应为2Cl-+2e-=Cl2
C.光照时,Cl-向Ag电极移动
D.光照时,电池总反应为
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学可充电池的反应规律(解析版) 题型:选择题
铁铬氧化还原液流电池是一种低成本的储能电池,电池结构如图所示,工作原理为Fe3++Cr2+ Fe2++Cr3+。下列说法一定正确的是
Fe2++Cr3+。下列说法一定正确的是
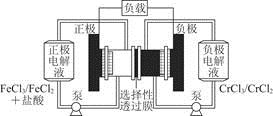
A.充电时,阴极的电极反应式为Cr3++e-=Cr2+
B.电池放电时,负极的电极反应式为Fe2+-e-=Fe3+
C.电池放电时,Cl-从负极室穿过选择性透过膜移向正极室
D.放电时,电路中每流过0.1 mol电子,Fe3+浓度降低0.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学化学平衡常数(解析版) 题型:填空题
700 ℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)  CO2(g)+H2(g);反应过程中测定的部分数据见下表(表中t2>t1),下列说法正确的是
CO2(g)+H2(g);反应过程中测定的部分数据见下表(表中t2>t1),下列说法正确的是
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 1.20 | 0.60 |
t1 | 0.80 |
|
t2 |
| 0.20 |
A.反应在t1min内的平均速率为v(H2)=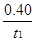 mol·L-1·min-1
mol·L-1·min-1
B.保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,达到平衡时n(CO2)=0.40 mol
C.保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小
D.温度升高至800 ℃,上述反应平衡常数为0.64,则正反应为吸热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com