
【题目】在恒温、恒压下,a mol A 和 b mol B 在一个容积可变的容器中发生反应:A(g)+2B(g)![]() 2C(g),一段时间后达到平衡,生成 n mol C。则下列说法中正确的是
2C(g),一段时间后达到平衡,生成 n mol C。则下列说法中正确的是
A.物质A、B的转化率之比为 1∶2
B.起始时刻和达到平衡后容器中的压强之比为(a+b)∶(a+b-0.5n)
C.当 2v 正(A)=v 逆(B)时,反应一定达到平衡状态
D.充入惰性气体(如Ar),平衡向正反应方向移动
科目:高中化学 来源: 题型:
【题目】反应A2(g)+B2(g) →2AB(g)的能量变化如图所示,叙述正确的是
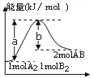
A. 该反应是放热反应
B. 加入催化剂,(b-a)的差值减小
C. 每生成2molAB分子吸收bkJ热量
D. 若反应生成AB为液态,吸收的热量小于(a-b)kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理消除工业污染,保护生态环境具有非常重要的意义。
(1)采取热还原法,用碳粉可将氮氧化物还原。
已知:①N2(g)+O2(g)=2NO(g) △H=+180.6kJ·mol-1;
②C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1。
则反应C(s)+2NO(g)=CO2(g)+N2(g) △H= kJ·mol-1。
(2)在催化剂作用下,将nmolSO2与nmolCl2充入容积可变的密闭容器中,发生反应:SO2(g)+ Cl2(g) ![]() SO2Cl2(g)(硫酰氯),并始终保持温度为T,压强为p。起始时气体总体积为10L,tmin时反应达到平衡状态,此时气体总体积为8L。
SO2Cl2(g)(硫酰氯),并始终保持温度为T,压强为p。起始时气体总体积为10L,tmin时反应达到平衡状态,此时气体总体积为8L。
①在容积改变的条件下,反应速率可用单位时间内反应物或生成物的物质的量变化来表示。则v(SO2)= ___ mol/min。
②此温度下,该反应的K= 。
③相同条件下,若将0.5nmolSO2与0.5nmolCl2充入该容器,到达平衡状态时,混合物中SO2Cl2的物质的量是 。
(3)利用氨水可以将SO2和NO2吸收,原理如图所示:

NO2被吸收的离子方程式是 。
(4)利用如下图所示装置(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO2。
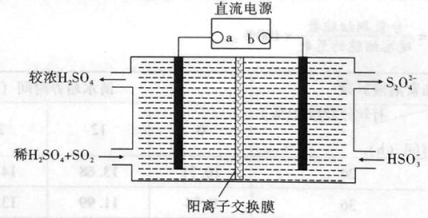
①阴极的电极反应式为 。
②在碱性条件下,用阴极排除的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁中常见的反应为:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) △H
2Fe(s)+3CO2(g) △H
(1)某实验小组在实验室模拟上述反应。一定温度下,在2L盛有Fe2O3粉末的恒容密闭容器中通入0.1molCO,5min时生成2.24gFe。5min内有CO表示的平均反应速率是______________mol·L-1min-1;5min时CO2的体积分数为___________;若将此时反应体系中的混合气体通入100mL0.9mol/L的NaOH溶液中,充分反应后所得溶液中离子浓度由大到小的顺序是__________________ 。
(2)上述反应的平衡常数表达式为:K=_______________;下列能说明该反应已经达到平衡状态的是_____________(填序号)。
a.容器内固体质量保持不变
b.容器中气体压强保持不变
c.c(CO)=c(CO2)
d.v正(CO)=v逆(CO2)
(3)已知上述反应的平衡常数K与温度T(单位:K)之间的关系如图所示,其中直线的斜率为-![]() (气体常数R=8.3×10-3kJ·mol-1·K-1)。
(气体常数R=8.3×10-3kJ·mol-1·K-1)。
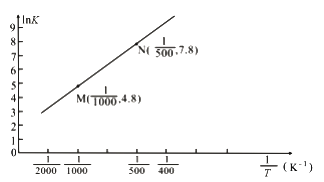
①根据图像可知,该反应的平衡常数随温度升高而____________(填“增大”、“减小”或“不变”)
②该反应的△H=_______________kJ·mol-1。
(4)结合上述有关信息,写出两条提高CO转化率的措施_____________、_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的工业原料。工业上利用反应在3Cl2+2NH3=N2+6HCl检查氯气管道是否漏气。下列说法错误的是
A.若管道漏气遇氨就会产生白烟 B.该反应利用了Cl2的强氧化性
C.该反应属于复分解反应 D.生成1molN2有6mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法没有体现“结构决定性质”的事实是
A. 丙烷的沸点比甲烷高
B. 金刚石比石墨更硬
C. 乙烯可以使溴水褪色,而乙烷不能
D. 金属钠比镁更活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向V L的密闭容器中充入一定量的A和B,发生反应:A(g)+B(g)![]() C(s)+xD(g);△H>0,容器中A、B、D的物质的量浓度随时间的变化如图所示。下列说法不正确的是
C(s)+xD(g);△H>0,容器中A、B、D的物质的量浓度随时间的变化如图所示。下列说法不正确的是

A.反应在前10min的平均反应速率v(B)=0.15mol/( L ·min)
B.该反应的平衡常数表达式K=![]()
C.若平衡时保持温度不变,压缩容器体积平衡向逆反应方向移动
D.反应至15min时,改变的条件是降低温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 焰色反应是化学变化
B. 电子从基态跃迁到激发态放出能量,产生发射光谱
C. 在一定条件下,碳原子的电子排布式可能是1s22s12p3
D. 自然界的原子都是基态
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com