
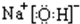 ,
,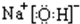 ;
;
| ||
| ||


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
 中华人民共和国国家标准规定葡萄酒中SO2最大使用量为0.25g?L-1.某兴趣小组用右图装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定.(可能用到的相对原子质量:H-1 O-16 S-32)
中华人民共和国国家标准规定葡萄酒中SO2最大使用量为0.25g?L-1.某兴趣小组用右图装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定.(可能用到的相对原子质量:H-1 O-16 S-32)查看答案和解析>>
科目:高中化学 来源: 题型:
| 电解 |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X分子中含C=C |
| B、制取X的过程中无小分子生成 |
| C、熔化的X与钠可反应产生H2 |
| D、上述适当的反应类型为加聚反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元 素 | M | F | |
| 电离能 (kJ?mol-1) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2C2 | 272 | 423 | 以任意比互溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol/L HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+) |
| B、0.1 mol/L CuSO4?(NH4)2SO4?6H2O溶液中:c(SO42-)>c(NH4+)>c(Cu2+)>c(H+)>c(OH-) |
| C、0.1 mol/L NaHCO3溶液中:c(Na+)+c(H+)+c(H2CO3)>c(HCO3-)+c(CO32-)+c(OH-) |
| D、等物质的量的NaX和弱酸HX混合后溶液中:c(Na+)>c(HX)>c(X-)>c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com