
【题目】如图是元素周期表中的前四周期,①~⑨为相应的元素,请从中选择合适的元素回答问题:
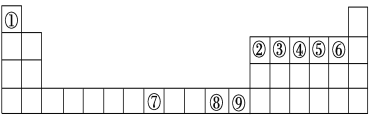
(1)根据元素原子的外围电子排布特征,元素周期表可划分为五个区域,⑨元素位于周期表的________区。
(2)④、⑥两元素形成的化合物的立体构型为________,其中心原子的杂化轨道类型为________。
(3)元素⑧的离子的氢氧化物不溶于水,但可溶于氨水中,该离子与NH3间结合的作用力为________。
(4)在周期表给出的9种元素中,电负性最大的元素基态原子的电子排布式为___________。
(5)在①与④形成的相对分子质量最小的化合物A中,元素④的杂化类型是____,写出与化合物A互为等电子体的一种阳离子______(填离子符号)。
(6)关于元素①与元素⑤形成的1︰1的化合物,下列说法正确的是______(填字母序号)。
A.该化合物中的所有原子都满足最外层8电子稳定结构
B.该化合物分子中σ键和π键数目比为1︰1
C.该化合物是由极性键和非极性键形成的极性分子
D.该化合物分子的空间构型为直线形
(7)元素⑦与CO可形成X(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断该化合物晶体属于________晶体(填晶体类型),化合物中⑦的化合价为:_______。根据等电子体理论,该化合物的配体的结构式为:_______,CaC2中,阴离子的电子式为: ____________________。
【答案】ds 三角锥形 sp3 配位键 1s22s22p5; sp3 H3O+ C 分子 0 ![]()

【解析】
根据元素周期表的位置,①为H、②为B、③为C、④为N、⑤为O、⑥为F、⑦为Fe、⑧为Cu、⑨为Zn;
(1)⑨为Zn元素,其价电子排布式为3d104s2;
(2) ④为N元素,⑥为F元素,两元素形成的化合物为NF3,N原子的价层电子对个数=3+![]() =4,其中孤电子对数为1;
=4,其中孤电子对数为1;
(3)元素⑧为Cu,Cu(OH)2溶于氨水,生成配离子[Cu(NH3)4]2+;
(4)元素的非金属性越强,电负性越大,则①~⑨中氟元素的电负性最大,其核电荷数为9;
(5) ①为H、④为N,两元素形成的相对分子质量最小的化合物为NH3,N原子的价层电子对个数=3+![]() =4,其中孤电子对数为1;
=4,其中孤电子对数为1;
(6)①⑤形成的原子数为1:1的物质是H2O2.其结构式为H-O-O-H,含有极性键,是极性分子;
(7)元素⑦与CO可形成的Fe(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5℃,沸点为103℃,熔沸点低,易溶于非极性溶剂,属于分子晶体;在Fe(CO)5在C元素为+2价,O为-2价,结合正负化合价代数和为0可知,Fe元素的化合价为0;CO和N2、![]() 均为等电子体,结合N2的结构写出CO的结构和
均为等电子体,结合N2的结构写出CO的结构和![]() 的电子式。
的电子式。
根据元素周期表的位置,①为H、②为B、③为C、④为N、⑤为O、⑥为F、⑦为Fe、⑧为Cu、⑨为Zn;
(1) ⑨为Zn元素,其价电子排布式为3d104s2,则锌元素位于周期表的ds区;
(2) ④为N元素,⑥为F元素,两元素形成的化合物为NF3,N原子的价层电子对个数=3+![]() =4,其中孤电子对数为1,则N原子的杂化轨道类型为sp3,NF3的立体构型为三角锥形;
=4,其中孤电子对数为1,则N原子的杂化轨道类型为sp3,NF3的立体构型为三角锥形;
(3) 元素⑧为Cu,Cu(OH)2溶于氨水,生成配离子[Cu(NH3)4]2+,,Cu2+离子与NH3间结合的作用力为配位键;
(4)元素①~⑨中氟元素的电负性最大,其核电荷数为9,基态氟原子的电子排布式为1s22s22p5;
(5) ①为H、④为N,两元素形成的相对分子质量最小的化合物为NH3,N原子的价层电子对个数=3+![]() =4,其中孤电子对数为1,则N原子的杂化类型是sp3,与NH3互为等电子体的一种阳离子为H3O+;
=4,其中孤电子对数为1,则N原子的杂化类型是sp3,与NH3互为等电子体的一种阳离子为H3O+;
(6)①⑤形成的原子数为1:1的物质是H2O2,其结构式为H-O-O-H;
A.分子中含有氢原子,氢原子达到2e-稳定结构,不是8e-,故A错误;
B.分子中不含π键,故B错误;
C.分子中H-O为极性键,O-O键为非极性键,H2O2为极性分子,故C正确;
D.H2O2分子中O原子是sp3杂化,则分子立体构型不是直线形结构,故D错误;
故答案为:C;
(7)元素⑦与CO可形成的Fe(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5℃,沸点为103℃,熔沸点低,易溶于非极性溶剂,属于分子晶体,根据等电子体理论,CO和N2、![]() 均为等电子体,N2分子的电子式为
均为等电子体,N2分子的电子式为![]() ,则CO的结构式为
,则CO的结构式为![]() ,
,![]() 的电子式为
的电子式为 。
。


科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论正确的是

A.图甲表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
B.图乙是金刚石与石墨分别氧化生成CO2的能量关系曲线,说明石墨转化为金刚石的反应的ΔH>0
C.图丙表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率大于b点
D.图丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则相同条件下NaA溶液的pH大于同浓度的NaB溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铁溶液水解可以得到一系列具有净水作用的碱式硫酸铁(xFe2O3ySO3zH2O),为测定某碱式硫酸铁的组成,取5.130g样品溶于足量盐酸中,然后加入过量的BaCl2溶液,经过滤、洗涤、干燥得白色固体5.825g,向上述滤液中加入过量的NaOH溶液,经过滤、洗涤、灼烧得到固体1.600g,该样品的化学式为( )
A.Fe2O32SO37H2OB.4Fe2O310SO325H2O
C.3Fe2O36SO320H2OD.2Fe2O35SO317H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是重要的基础化工原料,可以制备尿素[CO(NH2)2]、N2H4等多种含氮的化工产品。
(1)以NH3与CO2为原料可以合成尿素[CO(NH2)2],涉及的化学反应如下:
反应I:![]()
反应Ⅱ:![]()
反应Ⅲ:H2O(1)=H2O(g) △H3=+44.0 kJ·mol-1
则反应:![]() __________kJ/mol
__________kJ/mol
(2)将氨气与二氧化碳在有催化剂的反应器中反应![]() ,体系中尿素的产率和催化剂的活性与温度的关系如图1所示:
,体系中尿素的产率和催化剂的活性与温度的关系如图1所示:

①a点________(填是或不是)处于平衡状态,T1之后尿素产率下降的原因是___________________________。
②实际生产中,原料气带有水蒸气,图2表示CO2的转化率与氨碳比![]() 、水碳比
、水碳比![]() 的变化关系。曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是___________,测得b点氨的转化率为30%,则x=___________________。
的变化关系。曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是___________,测得b点氨的转化率为30%,则x=___________________。
③已知该反应的![]() ,
,![]() ,k(正)和k(逆)为速率常数,则平衡常数K与k(正),k(逆)的关系式是____________________________________。
,k(正)和k(逆)为速率常数,则平衡常数K与k(正),k(逆)的关系式是____________________________________。
(3)N2H4可作火箭推进剂。已知25℃时N2H4水溶液呈弱碱性:
![]() ;
;
![]()
①25℃时,向N2H4水溶液中加入H2SO4,欲使![]() ,同时
,同时![]() ,应控制溶液pH范围_____________(用含a、b式子表示)。
,应控制溶液pH范围_____________(用含a、b式子表示)。
②水合肼(N2H4·H2O)的性质类似一水合氨,与硫酸反应可以生成酸式盐,该盐的化学式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,3D-SiC@2D-MoS2异质接面催化剂具有优异的光催化CO2用纯水的全还原性能,有效实现电子/空穴的定向迁移,最终实现CO2和H2O在相应活性位点发生氧化还原反应,如图所示。下列叙述错误的是( )

A.2D-MoS2是H2O氧化的催化剂
B.H+和e-容易在SiC@MoS2催化剂间进行反应
C.中间产物的转化“HCOOH→HCHO→CH3OH”均发生还原反应
D.总反应的方程式为CO2(g)+2H2O(g)![]() CH4(g)+2O2(g)
CH4(g)+2O2(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
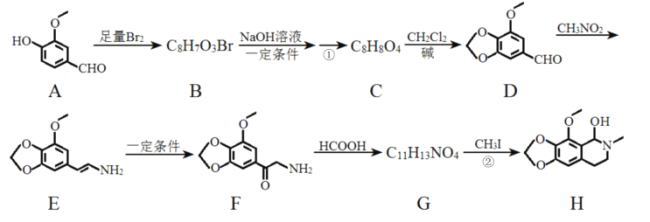
【题目】那可丁是一种药物,为支气管解痉性镇咳药,能解除支气管平滑肌痉挛,抑制肺牵张反射引起的咳嗽,化合物H是制备该药物的重要中间体,合成路线如图:
已知:
a.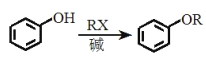 ;
;
b.RNH2![]() RNHCH3。
RNHCH3。
(1)反应①的条件为__。
(2)反应②的反应类型为__。
(3)化合物G的结构简式为__。
(4)下列说法正确的是__。
a.物质D能与FeCl3发生显色反应
b.物质F具有碱性
c.物质G能和银氨溶液发生反应
d.物质H的分子式是C12H15NO4
(5)写出C→D的化学方程式:__。
(6)满足下列条件,化合物A所有同分异构体有__种(不包括A)。
①可以与活波金属反应生成氢气,但不与NaHCO3溶液反应;
②分子中含有![]() 结构;
结构;
③含有苯环,且有两个取代基。
(7)已知CH2=CHCH3![]() CH2=CHCH2Cl,请以
CH2=CHCH2Cl,请以![]() 、CH3CHClCH3为原料合成化合物
、CH3CHClCH3为原料合成化合物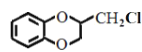 ,写出制备的合成路线流程图(无机试剂任选)__。
,写出制备的合成路线流程图(无机试剂任选)__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学院科研团队研究表明,在常温常压和可见光下,基于LDH(一种固体催化剂)合成NH3的原理示意图。下列说法不正确的是

A.该过程中H2O被还原生成氧气
B.该过程中涉及极性键和非极性键的断裂与生成
C.基于合成NH3的过程属于氮的固定
D.该过程的化学方程式为:2N2+6H2O![]() 4NH3+3O2
4NH3+3O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业排放物可能对环境和人体健康产生危害,必须经过处理才可排放。根据题意回答下列问题。
Ⅰ.处理含SO2、NO的烟气
在323 K温度下,向盛有NaClO2溶液的鼓泡反应器中通入含有SO2和NO的烟气。
(1)写出NaClO2溶液脱硝过程中反应的离子方程式___________________ 。
(2)由实验测得,脱硫反应速率大于脱硝反应速率,原因是除了SO2和NO在烟气中的初始浓度不同,还可能是___________。
(3)采用NaClO、Ca(ClO) 2替代NaClO2,也能较好的除去SO2。从化学平衡原理分析,Ca(ClO) 2相比NaClO具有的优点是___________________。
Ⅱ.处理含H2S的烟气
生物脱H2S原理为:
H2S(g) + Fe2(SO4)3(aq) = S(s) + 2FeSO4(aq) + H2SO4(aq) ΔH1
4FeSO4(aq) + O2(g) + 2H2SO4(aq) ![]() 2Fe2(SO4)3(aq) + 2H2O(l) ΔH2
2Fe2(SO4)3(aq) + 2H2O(l) ΔH2
(1)反应2H2S(g) + O2 (g) = 2S(s) + 2H2O(l) 的ΔH3=___________________。
(2)若反应温度过高,反应速率下降(如图),其原因是______________。

Ⅲ.处理污水的化学方法有许多,混凝法、氧化还原法、中和法、电解法等。处理含Na2SO4的废水常用三室式电渗析法,原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。

(1)负极反应式为___________________。
(2)当电路中通过1![]() 电子的电量时,会有_________
电子的电量时,会有_________![]() 的O2生成。
的O2生成。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.CH3COOCH2CH3 与CH3CH2COOCH3 中均含有甲基、乙基和酯基,为同一种物质
B.![]() 和
和 ![]() 为同一物质
为同一物质
C.CH3CH2CH2CH2CH3 和CH3CH2CH(CH3)2 互为同素异形体
D.CH3CH2OH 和 CH2OHCHOHCH2OH 具有相同的官能团,互为同系物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com