
【题目】分类方法在化学学科的发展中起了非常重要的作用,如图是某反应在密闭容器中反应前后的分子状况示意图,![]() 和
和![]() 分别表示不同的原子。对此反应的分类不正确的是( )
分别表示不同的原子。对此反应的分类不正确的是( )
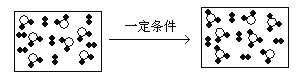
A.化合反应B.加成反应C.可逆反应D.氧化还原反应
【答案】B
【解析】
根据图知,反应物中有一种化合物和一种单质,反应后的容器中有一种单质和两种化合物,其中反应后的容器中的单质和一种化合物与反应容器中的相同,则实质上生成物是一种化合物,则反应物是一种单质和一种化合物,生成物是一种化合物,根据反应物和生成物种类反应特点来判断。
根据图知,反应物中有一种化合物和一种单质,反应后的容器中有一种单质和两种化合物,其中反应后的容器中的单质和一种化合物与反应容器中的相同,则实质上生成物是一种化合物,即反应物是一种单质和一种化合物,生成物是一种化合物,根据原子的相对大小,可知该图示表示反应:2SO2+O2![]() 2SO3,该反应是化合反应,属于可逆反应,应用反应前后有元素化合价的变化,属于氧化还原反应,不是加成反应,故合理选项是B。
2SO3,该反应是化合反应,属于可逆反应,应用反应前后有元素化合价的变化,属于氧化还原反应,不是加成反应,故合理选项是B。


科目:高中化学 来源: 题型:
【题目】能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一。
(1)合成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g);下图表示某次合成实验过程中甲醇的体积分数φ(CH3OH)与反应温度的关系曲线,则该反应的△H__________0。(填“>、<或=”下同)
CH3OH(g);下图表示某次合成实验过程中甲醇的体积分数φ(CH3OH)与反应温度的关系曲线,则该反应的△H__________0。(填“>、<或=”下同)

(2)在某温度下,向一个容积不变的密闭容器中通入2.5mol CO和7.5mol H2,达到平衡时CO的转化率为90%,此时容器内的压强为开始时的__________倍。
(3)利用甲醇燃料电池设计如图所示的装置:

①则该装置中b为____________极,写出装置中电解池内发生反应的离子方程式_______________________。
②当锌片的质量变化为12.8 g时,a极上消耗的O2 在标准状况下的体积为___________L。
(4)低碳经济是以低能耗、低污染、低排放为基础的经济模式,其中一种技术是将CO2转化成有机物实现碳循环。如:
2CO2(g)+2H2O(l)= C2H4(g)+3O2(g) ΔH=+1411.0 kJ/mol
2CO2(g)+3H2O(l)= C2H5OH(1)+3O2(g) ΔH=+1366.8 kJ/mol
则由乙烯水化制乙醇反应的热化学方程式____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 硫酸铝溶液中滴加过量浓氨水:Al3+ + 4OH- = AlO![]() + 2H2O
+ 2H2O
B. NaHCO3溶液水解:HCO![]() + H2O = H2CO3 + OH-
+ H2O = H2CO3 + OH-
C. 浓氢氧化钠溶液吸收少量SO2气体:SO2+ 2OH- = SO![]() + H2O
+ H2O
D. 向小苏打溶液中加入醋酸溶液:HCO![]() + H+= CO2↑+ H2O
+ H+= CO2↑+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种主族元素的离子aXm+、bYn+、cZn-和dRm-(a、b、c、d为元素的原子序数),它们具有相同的电子层结构,若m>n,对下列叙述的判断正确的是( )
①a-b=n-m
②元素的原子序数a>b>c>d
③元素非金属性Z>R
④最高价氧化物对应水化物碱性X>Y
A.③B.①②③④C.①②③D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向物质的量浓度相等的NaCl和Na2CrO4溶液中分别滴加AgNO3溶液(Ag2CrO4为砖红色),平衡时溶液中相关离子浓度的关系如图所示。下列说法正确的是( )
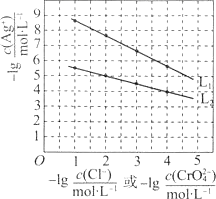
A.Ksp(AgCl)的数量级为10-12
B.L1为Na2CrO4溶液中滴加AgNO3溶液时离子浓度关系曲线
C.用AgNO3标准溶液测定溶液中Cl-含量时可用Na2CrO4作指示剂
D.L1和L2交点处对应的两种溶液中c(Ag+)=c(Cl-)=c(CrO42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下:
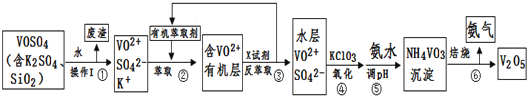
请回答下列问题:
(1)步骤①所得废渣的成分是____________写化学式),操作I的名称______。
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n(水层)+ 2nHA(有机层)![]() 2RAn(有机层) + nH2SO4 (水层)
2RAn(有机层) + nH2SO4 (水层)
②中萃取时必须加入适量碱,其原因是____________________________。
③中X试剂为___________________。
(3)⑤的离子方程式为________________________。
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为__________;
若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)<_____________。
(已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39)
(5)该工艺流程中,可以循环利用的物质有______________和_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关离子水解的方程式中正确的是。
A.NH4Cl溶液在重水(D2O)中水解:NH4++D2O ![]() NH3HDO+D+
NH3HDO+D+
B.![]() 溶液:
溶液:![]()
![]() HPO42-+H3O+
HPO42-+H3O+
C.![]() 溶液:
溶液:![]()
![]() H2CO3+2OH-
H2CO3+2OH-
D.![]() 溶液:
溶液:![]() =Fe(OH)3↓+3H+
=Fe(OH)3↓+3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据水解反应离子方程式的书写原则及其注意的问题,判断下列选项正确的是( )
A. FeCl3+3H2O===Fe(OH)3↓+3HCl
B. Al2S3+6H2O![]() 2Al(OH)3+3H2S
2Al(OH)3+3H2S
C. S2-+2H2O![]() H2S+2OH-
H2S+2OH-
D. HCO3-+H2O![]() H2CO3+OH-
H2CO3+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是可逆反应 A + 2B![]() 2C + 3D 的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断
2C + 3D 的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断
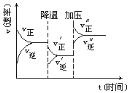
A.若 A、B 是气体,则 D 是液体或固体
B.A、B、C、D均为气体
C.逆反应是放热反应
D.达平衡后,v(A)正 = 2v(C)逆
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com