
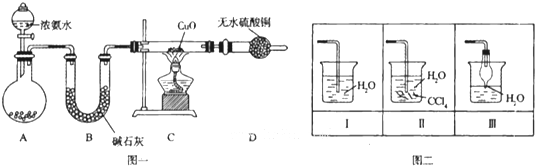
分析 浓氨水在碱石灰或生石灰的作用下挥发生成氨气,在B中用碱石灰干燥,在C中加热体积与氧化铜发生氧化还原反应生成水、氮气和铜,D可用于检验是否生成水,最后氨气用水吸收,因氨气极易溶于水,注意防止倒吸,
(1)装置A是制备氨气的发生装置,浓氨水滴入固体碱石灰或氧化钙或固体氢氧化钠都可以生成氨气;B装置是吸收水蒸气的作用;
(2)依据装置图分析,先反应生成氨气再加热装置C;
(3)依据反应现象可知,氧化铜氧化氨气为氮气,氧化铜被还原为铜;
(4)氨气极易溶于水尾气吸收需要防止倒吸;
(5)依据氨水溶液中溶质为氨气,结合物质的量浓度概念计算.
解答 解:浓氨水在碱石灰或生石灰的作用下挥发生成氨气,在B中用碱石灰干燥,在C中加热体积与氧化铜发生氧化还原反应生成水、氮气和铜,D可用于检验是否生成水,最后氨气用水吸收,因氨气极易溶于水,注意防止倒吸,
(1)装置A是制备氨气的发生装置,浓氨水滴入固体碱石灰或氧化钙或固体氢氧化钠都可以生成氨气,浓硫酸和氨气发生反应,氨气易溶入烧碱溶液,不选择浓硫酸、氢氧化钠溶液制备氨气,所以装置A中试剂为:a.碱石灰,c.生石灰;B装置中的碱石灰是吸收水蒸气,干燥氨气的作用,
故答案:ac;干燥氨气;
(2)连接好装置并检验装置的气密性后,装入药品,打开旋塞逐滴向圆底烧瓶中加入氨水发生反应生成氨气,故答案为:Ⅰ;
(3)实验中观察到C中CuO粉末变红证明生成铜,D中无水硫酸铜变蓝生成水,并收集到一种单质气体,依据氧化还原反应分析,氧化铜氧化氨气为氮气,氧化铜被还原为铜,反应的化学方程式为:3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O;氮元素化合价升高为0价,做还原剂具有还原性,
故答案为:3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O;还原;
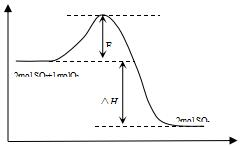
(4)氨气极易溶于水尾气吸收需要防止倒吸,图二中能用来吸收尾气的装置是Ⅱ、Ⅲ,装置Ⅰ易发生倒吸,故答案为:Ⅱ、Ⅲ;
(5)氨气极易溶于水,若标准状况下,将2.24L的氨气溶于水配成0.5L溶液,溶质氨气物质的量为0.1mol,所得溶液的物质的量浓度=$\frac{0.1mol}{0.5L}$=0.2mol/L,
故答案为:0.2.
点评 本题考查氨气的制备以及氨气的性质探究,为高考常见题型和高频考点,侧重于学生的分析能力和实验能力的考查,注意把握实验的原理以及实验基本操作方法,难度中等.


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案科目:高中化学 来源: 题型:解答题
 2SO2(g)+O2(g)?2SO3(g)△H<0,是工业制硫酸的主要反应之一.
2SO2(g)+O2(g)?2SO3(g)△H<0,是工业制硫酸的主要反应之一.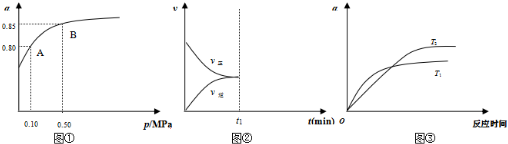
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化反应 | B. | 加成反应 | C. | 酯化反应 | D. | 水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.77×10-4 | 4.9×10-16 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | 2CN-+H2O+CO2═2HCN+CO32- | |
| B. | 2HCOOH+CO32-═2HCOO-+H2O+CO2↑ | |
| C. | 中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者 | |
| D. | HCOOH+CN-═HCOO-+HCN |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 果糖 | B. | 麦芽糖 | C. | 淀粉 | D. | 蔗糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向沸水中滴加饱和氯化铁溶液制备胶体,用可见光束照射,产生丁达尔效应 | |
| B. | 常温下,向0.10mol•L-1NaHCO3溶液,滴加CaCl2溶液至pH=7,滴加过程中产生白色沉淀,但无气体放出,说明加入CaCl2促进了HCO3-的水解 | |
| C. | 利用以下实验器材(规格数量不限):烧杯、量筒、环形玻璃搅拌棒、纸条、硬纸板、温度计能完成中和反应反应热的测定 | |
| D. | 向浓度均为0.1mol•L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,先出现蓝色沉淀,因为KSP[Mg(OH)2]>KSP[Cu(OH)2] |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
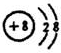 .
.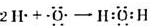 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入氢气的电极为原电池的正极 | |
| B. | 两极材料都用石墨,用稀盐酸做电解质溶液 | |
| C. | 电解质溶液中的阳离子向通氯气的电极移动 | |
| D. | 通氯气的电极反应式为Cl2+2e-═2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -OH与OH-具有相同的质子数 | |
| B. | 在葡萄糖溶液中加入银氨溶液,一会儿就会看到光亮的银析出 | |
| C. | 检验乙醇中是否含有水可用无水硫酸铜 | |
| D. | 某有机物在氧气中燃烧生成CO2和H2O,则该有机物可能是烃 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com