
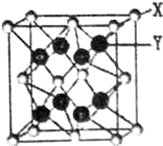
 X与Y可形成离子化合物,其晶胞结构如下图所示.其中X离子的配位数为8,若该晶体的密度为pg•cm3,X和Y的相对原子质量分别为a和b,则晶胞中距离最近的X、Y之间的核间距离是$\frac{{\sqrt{3}}}{4}×\root{3}{{\frac{4a+8b}{{ρ•{{N}_A}}}}}$cm(NA表示阿伏伽德罗常数,用含p、a、b、NA的代数式表达).
X与Y可形成离子化合物,其晶胞结构如下图所示.其中X离子的配位数为8,若该晶体的密度为pg•cm3,X和Y的相对原子质量分别为a和b,则晶胞中距离最近的X、Y之间的核间距离是$\frac{{\sqrt{3}}}{4}×\root{3}{{\frac{4a+8b}{{ρ•{{N}_A}}}}}$cm(NA表示阿伏伽德罗常数,用含p、a、b、NA的代数式表达). 分析 依据晶胞结构可知晶体中与X离子距离最近的Y离子有8个,所以其配位数为8;根据均摊法计算晶胞中X、Y原子数目,进而计算晶胞的质量,根据m=ρV计算晶胞体积,进而计算晶胞棱长x.Y原子与周围4个X原子形成正四面体结构,令Y与X之间的距离为y,则正四面体中心到底面中心的距离为$\frac{y}{3}$,正四面体的高为$\frac{4}{3}$y,正四面体棱长=$\frac{\sqrt{2}x}{2}$,则正四面体侧面的高为$\frac{\sqrt{2}x}{2}$×$\frac{\sqrt{3}}{2}$,底面中心到边的距离为$\frac{\sqrt{2}x}{2}$×$\frac{\sqrt{3}}{2}$×$\frac{1}{3}$,再根据勾股定理进行解答.
解答 解:由晶胞结构可知晶体中与X离子距离最近的Y离子有8个;
晶胞中X原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4、Y原子数目为8,晶胞的质量为$\frac{4a+8b}{{N}_{A}}$g,晶体密度为ρg/cm3,则晶胞体积为$\frac{4a+8b}{{N}_{A}}$g÷ρg/cm3,故晶胞棱长x=$\root{3}{\frac{4a+8b}{ρ{N}_{A}}}$cm;
Y原子与周围4个X原子形成正四面体结构,令Y与X之间的距离为y,则正四面体中心到底面中心的距离为$\frac{y}{3}$,正四面体的高为$\frac{4}{3}$y,正四面体棱长=$\frac{\sqrt{2}x}{2}$,则正四面体侧面的高为$\frac{\sqrt{2}x}{2}$×$\frac{\sqrt{3}}{2}$,底面中心到边的距离为$\frac{\sqrt{2}x}{2}$×$\frac{\sqrt{3}}{2}$×$\frac{1}{3}$,故($\frac{4}{3}$y)2+($\frac{\sqrt{2}x}{2}$×$\frac{\sqrt{3}}{2}$×$\frac{1}{3}$)2=($\frac{\sqrt{2}x}{2}$×$\frac{\sqrt{3}}{2}$)2,整理得:y=$\frac{\sqrt{3}}{4}$x,故Y与X的距离为:$\frac{{\sqrt{3}}}{4}×\root{3}{{\frac{4a+8b}{{ρ•{{N}_A}}}}}$;
故答案为:8; $\frac{{\sqrt{3}}}{4}×\root{3}{{\frac{4a+8b}{{ρ•{{N}_A}}}}}$.
点评 本题考查了有关晶胞的计算,明确晶胞结构特点是解题关键,需要学生具备一定空间想象能力和数学运算能力,难度较大.


科目:高中化学 来源: 题型:选择题
| A. | KClO3在反应中是还原剂 | |
| B. | 1molKClO3参加反应,在标准状况下能得到22.4L气体 | |
| C. | 反应中H2C2O4既不是氧化剂也不是还原剂 | |
| D. | 1molKClO3参加反应有1mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石英玻璃、分子筛的主要成分是硅酸盐 | |
| B. | 分散系可分为溶液、浊液和胶体,浊液的分散质粒子大小介于溶液和胶体之间 | |
| C. | 铁在氧气中燃烧生成氧化铁,镁在空气中燃烧生成氧化镁、氮化镁 | |
| D. | 针对埃博拉病毒扩散情况,可选用含氯消毒剂对疫区可能的污染区域进行消毒预防 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
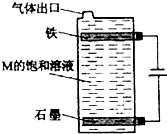 甲、乙、丙、丁、戊为原子序数依次增大的短周期元素.甲、丙处于同一主族,丙、丁、戊处于同一周期,戊的负一价阴离子与丙的阳离子差8个电子.甲、乙组成的常见气体X能使湿润的红色石蕊试纸变蓝;戊的单质与X反应能生成乙的单质,
甲、乙、丙、丁、戊为原子序数依次增大的短周期元素.甲、丙处于同一主族,丙、丁、戊处于同一周期,戊的负一价阴离子与丙的阳离子差8个电子.甲、乙组成的常见气体X能使湿润的红色石蕊试纸变蓝;戊的单质与X反应能生成乙的单质,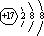 .
.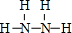 ;该物质与空气在碱性条件下可构成燃料电池,该电池放电时,负极的反应式为N2H4+4OH--4e-=N2↑+2H2O.
;该物质与空气在碱性条件下可构成燃料电池,该电池放电时,负极的反应式为N2H4+4OH--4e-=N2↑+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
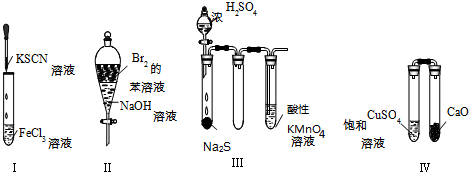
| A. | 实验Ⅰ:试管中溶液颜色变为红色 | |
| B. | 实验Ⅱ:振荡后静置,上层溶液颜色保持不变 | |
| C. | 实验Ⅲ:酸性KMnO4溶液中出现气泡,但颜色不会褪去 | |
| D. | 实验Ⅳ:放置一段时间后,饱和CuSO4溶液中出现蓝色晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定不存在Ba2+,NH4+可能存在 | B. | CO32- 可能存在 | ||
| C. | Na+一定存在 | D. | 一定不存在Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称量NaOH固体时,放在烧杯中且称量较慢 | |
| B. | 定容时,俯视刻度线 | |
| C. | 定容时,加水超过刻度线,再用胶头滴及将过线的液体吸出 | |
| D. | 移液前,容量瓶中有少量蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 .
.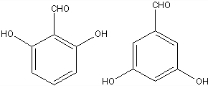 、
、 (任意一种).
(任意一种).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com