
【题目】四溴化钛(TiBr4)可用作橡胶工业中烯烃聚合反应的催化剂。已知TiBr4常温下为橙黄色固体,熔点为38.3℃,沸点为233.5℃,具有潮解性且易发生水解。实验室利用反应TiO2+C+2Br2![]() TiBr4+CO2制备TiBr4的装置如图所示。回答下列问题:
TiBr4+CO2制备TiBr4的装置如图所示。回答下列问题:
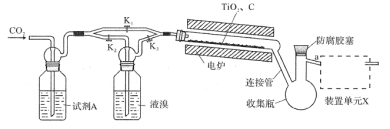
(1)检查装置气密性并加入药品后,加热前应进行的操作是__,其目的是__,此时活塞K1,K2,K3的状态为__;一段时间后,打开电炉并加热反应管,此时活塞K1,K2,K3的状态为____。
(2)试剂A为__,装置单元X的作用是__;反应过程中需用热源间歇性微热连接管,其目的是___。
(3)反应结束后应继续通入一段时间CO2,主要目的是___。
(4)将连接管切断并熔封,采用蒸馏法提纯。此时应将a端的仪器改装为__、承接管和接收瓶,在防腐胶塞上加装的仪器是___(填仪器名称)。
【答案】打开K1,关闭K2和K3 先通入过量的CO2气体,排除装置内空气 打开K1,关闭K2和K3 打开K2和K3 ,同时关闭K1 浓硫酸 吸收多余的溴蒸气同时防止外界的水蒸气使产物水解 防止产品四溴化钛凝固成晶体,堵塞连接管,造成危险 排出残留在装置中的TiBr4和溴蒸气 直形冷凝管 温度计(量程250°C)
【解析】
⑴检查装置气密性并加入药品后,加热前应进行排除装置内的空气,防止反应物碳单质与氧气反应,浪费原料,还可能产生有毒气体CO等,污染空气,开始仅仅是通入CO2气体,所以只需要打开K1,关闭K2和K3,打开电炉并加热反应管,此时需要打开K2和K3,同时关闭K1,保证CO2气体携带溴蒸气进入反应装置中。
⑵因为产品四溴化钛易发生水解,因此整套装置需要保持干燥,因此进入的CO2气体必须干燥,装置单元X应为尾气处理装置,吸收多余的溴蒸气,同时还能防止空气中的水蒸气干扰实验,防止产品四溴化钛水解变质。
⑶反应结束后在反应装置中还有少量四溴化钛残留,以及剩余的溴蒸气,应继续通入一段时间CO2,主要目的是把少量残留四溴化钛排入收集装置中,提高产率,而且还可以排出剩余的溴蒸气,进行尾气处理,防止污染。
⑷实验结束后,将连接管切断并熔封,采用蒸馏法提纯,因此需要用到直形冷凝管。
⑴检查装置气密性并加入药品后,加热前应进行排除装置内的空气,防止反应物碳单质与氧气反应,浪费原料,还可能产生有毒气体CO等,污染空气,因此加热实验前应先通入过量的CO2气体,其目的是排除装置内空气。此时仅仅是通入CO2气体,所以只需要打开K1,关闭K2和K3;而反应开始一段时间后,打开电炉并加热反应管,此时需要打开K2和K3,同时关闭K1,保证CO2气体携带溴蒸气进入反应装置中,故答案为:先通入过量的CO2气体;排除装置内空气;打开K1,关闭K2和K3;打开K2和K3,同时关闭K1。
⑵因为产品四溴化钛易发生水解,因此整套装置需要保持干燥,因此进入的CO2气体必须干燥,所以试剂A为浓硫酸(作干燥剂),装置单元X应为尾气处理装置,吸收多余的溴蒸气,同时还能防止空气中的水蒸气干扰实验,防止产品四溴化钛水解变质。反应过程中需用热源间歇性微热连接管,其目的是防止产品四溴化钛凝固成晶体,堵塞连接管,造成危险,用热源间歇性微热连接管可以使产品四溴化钛加热熔化,流入收集装置中,故答案为:浓硫酸;吸收多余的溴蒸气同时防止外界的水蒸气使产物水解;防止产品四溴化钛凝固成晶体,堵塞连接管,造成危险。
⑶反应结束后在反应装置中还有少量四溴化钛残留,以及剩余的溴蒸气,应继续通入一段时间CO2,主要目的是把少量残留四溴化钛排入收集装置中,提高产率,而且还可以排出剩余的溴蒸气,进行尾气处理,防止污染,故答案为:排出残留在装置中的TiBr4和溴蒸气。
⑷实验结束后,将连接管切断并熔封,采用蒸馏法提纯。在产品四溴化钛中还有残留的液溴,因此根据题中给出的四溴化钛的沸点233.5°C,可以使用蒸馏法提纯;此时应将a端的仪器改装为直形冷凝管、承接管和接收瓶,在防腐胶塞上加装的仪器是温度计(量程是250°C),故答案为:直形冷凝管;温度计(量程250°C)。


科目:高中化学 来源: 题型:
【题目】已知以下的热化学反应方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=—24.8kJ·mol-1
②Fe2O3(s)+![]() CO(g)=
CO(g)=![]() Fe3O4(s)+
Fe3O4(s)+![]() CO2(g) △H=—15.73kJ·mol-1
CO2(g) △H=—15.73kJ·mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=+640.4kJ·mol-1
则14gCO气体还原足量FeO固体得到Fe固体和CO2气体时对应的△H约为( )
A.-218kJ·mol-1B.-109kJ·mol-1C.+218kJ·mol-1D.+109kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普通立德粉(BaSO4·ZnS)广泛用于工业生产中,可利用ZnSO4和BaS共沉淀法制备。以粗氧化锌(含Zn、CuO、FeO等杂质)和BaSO4为原料制备立德粉的流程如下:
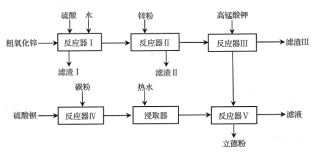
(1)生产ZnSO4的过程中,反应器Ⅰ要保持强制通风,原因是___。
(2)加入锌粉的主要目的是___(用离子方程式表示)。
(3)已知KMnO4在酸性溶液中被还原为Mn2+,在弱酸性、弱碱性溶液中被还原为MnO2,在碱性溶液中被还原为MnO42-。据流程判断,加入KMnO4时溶液的pH应调至___;
a.2.2~2.4 b.5.2~5.4 c.12.2~12.4
滤渣Ⅲ的成分为____。
(4)制备BaS时,按物质的量之比计算,BaSO4和碳粉的投料比要大于1:2,目的是__;生产过程中会有少量氧气进入反应器Ⅳ,反应器Ⅳ中产生的尾气需用碱液吸收,原因是__。
(5)普通立德粉(BaSO4·ZnS)中ZnS含量为29.4%,高品质银印级立德粉中ZnS含量为62.5%。在ZnSO4、BaS、Na2SO4、Na2S中选取三种试剂制备银印级立德粉,所选试剂为___,反应的化学方程式为__(已知BaSO4相对分子质量为233,ZnS相对分子质量为97)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,化学反应的ΔH前者大于后者的是( )
①C(s)+O2(g)= CO2(g)ΔH1;C(s)+ ![]() O2(g)= CO(g)ΔH2
O2(g)= CO(g)ΔH2
②S(s)+O2(g)= SO2(g)ΔH3;S(g)+O2(g)=SO2(g)ΔH4
③H2(g)+ ![]() O2(g)=H2O(l)ΔH5;2H2(g)+O2(g)= 2H2O(l)ΔH6
O2(g)=H2O(l)ΔH5;2H2(g)+O2(g)= 2H2O(l)ΔH6
④CaCO3(s)= CaO(s)+CO2(g)ΔH7;CaO(s)+H2O(l)= Ca(OH)2(s)ΔH8
A.①B.④C.②③④D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热催化合成氨面临的两难问题是:采用高温增大反应速率的同时会因平衡限制导致NH3产率降低。我国科研人员研制了Ti-H-Fe双温区催化剂(Ti-H区域和Fe区域的温度差可超过100℃)。Ti-H-Fe双温区催化合成氨的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注。下列说法正确的是( )

A. ①为N![]() N的断裂过程
N的断裂过程
B. ①②③在高温区发生,④⑤在低温区发生
C. ④为N原子由Fe区域向Ti-H区域的传递过程
D. 使用Ti-H-Fe双温区催化剂使合成氨反应转变为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(10分) 某温度(t℃)时,测得0.01 mol/L的NaOH溶液的pH为11,则该温度下水的Kw=________,该温度________25℃(填“大于”“小于”或“等于”),其理由是________________________________________________________________________
________________________________________________________________________.
此温度下,将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液VbL混合,通过计算填写以下不同情况时两溶液的体积比:
(1) 若所得溶液为中性,且a=12,b=2,则Va∶Vb=____________;
(2) 若所得溶液为中性,且a+b=12,则Va∶Vb=________;
(3) 若所得溶液的pH=10,且a=12,b=2,则Va∶Vb=______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在工农业生产和日常生活中都有着重要的应用.下列叙述不正确的是![]()
A.长期使用![]() 化肥会使土壤酸化,而过度使用尿素
化肥会使土壤酸化,而过度使用尿素![]() 会使土壤碱化
会使土壤碱化
B.锅炉水垢中含有的![]() ,可先用
,可先用![]() 溶液处理,后用酸除去
溶液处理,后用酸除去
C.铝合金的大量使用归功于人们能用焦炭等还原剂从氧化铝中获取铝单质
D.“酸可以除锈”、“热的纯碱溶液去油污”,都发生了化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M(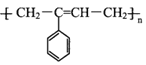 )是一种高分子化合物,它的合成路线如图所示:
)是一种高分子化合物,它的合成路线如图所示:
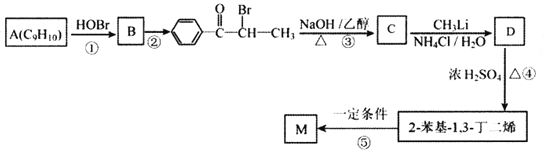
已知:①R-CH=CH2![]() R-CH(OH)CH2Br
R-CH(OH)CH2Br
②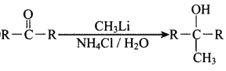
回答下列问题:
(1)反应①的反应类型为__________,D中的官能团名称是__________。
(2)A的名称是__________(系统命名法)。
(3)反应②的条件为__________;反应③的化学方程式为__________。
(4)H为B的同分异构体,满足下列条件的结构共有__________种(不含立体异构);其中核磁共振氢谱中出现4组峰,且峰面积之比为6:2:2:1的是__________ (写出结构简式)。
i.苯环上有两个取代基;ⅱ.与FeCl3溶液发生显色反应。
(5)参照上述合成路线,以![]() 为原料(其他原料任选)制备
为原料(其他原料任选)制备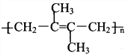 ,请设计合成路线__________。
,请设计合成路线__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如下:

1 mol NH4+(aq)全部氧化成NO3-(aq)的热化学方程式是___________________。
(2)工业上常用CO和H2合成甲醇,反应方程式为:CO(g) +2H2(g)![]() CH3OH (g) ΔH,在T1时,体积为2 L的恒容容器中充入物质的量之和为3 mol的H2和CO,达到平衡时CH3OH的体积分数(V %)与n(H2)/n(CO)的关系如图1所示。
CH3OH (g) ΔH,在T1时,体积为2 L的恒容容器中充入物质的量之和为3 mol的H2和CO,达到平衡时CH3OH的体积分数(V %)与n(H2)/n(CO)的关系如图1所示。

①当起始n(H2)/n(CO)=2,经过5 min达到平衡,此时容器的压强是初始压强的0.7倍,则0~5 min内平均反应速率v(H2)=________。若此时再向容器中加入0.15 mol CO (g)和0.05 mol CH3OH(g),达新平衡时H2的转化率将________(填“增大”“减小”或“不变”)。
②当起始n(H2)/n(CO)=3.5时,达到平衡状态后,CH3OH的体积分数可能是图像中的____点(填“D”“E”或“F”)。
③由图2可知该反应的ΔH________0(填“>”“<”或“=”),理由是______________;当压强为p2时,在y点:v正________v逆(填“>”“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com