
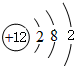 、
、 ,C的离子结构示意图
,C的离子结构示意图
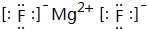 化学键类型为离子键.
化学键类型为离子键. 分析 A、B、C、D四种元素,A元素原子的第一层和第三层电子数相同,第三层电子数为2,故A为Mg;B元素原子的第二层比第一层电子数多5个,第二层电子数为7,故B为F元素;C元素的+3价阳离子和氖原子具有相同的电子数,则C为Al;D元素的原子核外有4个电子层,第一层与第二层电子数之和等于第三层与第四层电子数之和,则第三层、第四层电子数之和为10,说明原子核外各层电子数分别为2、8、8、2,故D为Ca元素,据此解答.
解答 解:(1)A、B、C、D四种元素,A元素原子的第一层和第三层电子数相同,第三层电子数为2,故A为Mg;B元素原子的第二层比第一层电子数多5个,第二层电子数为7,故B为F元素;C元素的+3价阳离子和氖原子具有相同的电子数,则C为Al;D元素的原子核外有4个电子层,第一层与第二层电子数之和等于第三层与第四层电子数之和,则第三层、第四层电子数之和为10,说明原子核外各层电子数分别为2、8、8、2,故D为Ca元素,
故答案为:Mg;F;Al;Ca;
(2)A为Mg,原子结构示意图为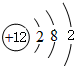 ,D为Ca,原子结构示意图为
,D为Ca,原子结构示意图为 ,C的离子为Al3+,离子结构示意图为
,C的离子为Al3+,离子结构示意图为 ,
,
故答案为: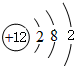 ;
; ;
; ;
;
(3)A与B所形成的化合物为MgF2,电子式为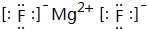 ,含有离子键,
,含有离子键,
故答案为: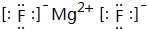 ,离子键.
,离子键.
点评 本题考查结构与位置关系应用,关键是理解掌握核外电子排布规律,侧重对化学用语的考查,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 两电极上产生的气体质量之比为4:1 | |
| B. | 两电极上产生的气体质量之比为8:1 | |
| C. | 相同状况下两电极上产生的气体体积之比为1:1 | |
| D. | 若两电极上产生的气体质量比为16:3,则D2O与H2O的物质的量之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeS2既是氧化剂,又是还原剂 | |
| B. | FeSO4溶液保存过程中需加稀硫酸和铁粉,防止变质 | |
| C. | 每生产1molFeSO4,转移的电子数为28NA | |
| D. | 硫酸工业中煅烧黄铁矿,其氧化产物只有SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳的燃烧热为△H=-110.5 kJ/mol | |
| B. | 1molC(s)所具有的能量一定高于1molCO(g)所具有的能量 | |
| C. | 稀硫酸与稀NaOH溶液反应的中和热为△H=-57.3 kJ/mol | |
| D. | 稀醋酸与稀NaOH溶液反应生成1 mol水,也放出57.3 kJ 热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达平衡所需时间/min | ||
| CO | H2O | CO | H2 | |||
| 1 | 650 | 2 | 4 | 0.5 | 1.5 | 5 |
| 2 | 900 | 1 | 2 | 0.5 | 0.5 | - |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com