
 .
. 分析 A、B、C、D是周期表中前10号元素,它们的原子半径依次减小.D能分别与A、B、C形成电子总数相等的分子M、N、W,且在M、N、W分子中,A、B、C 三原子都采取sp3杂化,则A、B、C、D分别为碳、氮、氧、氢,M为CH4、N为NH3、W为H2O.
解答 解:A、B、C、D是周期表中前10号元素,它们的原子半径依次减小.D能分别与A、B、C形成电子总数相等的分子M、N、W,且在M、N、W分子中,A、B、C 三原子都采取sp3杂化,则A、B、C、D分别为碳、氮、氧、氢,M为CH4、N为NH3、W为H2O.
①N为NH3,因为氨分子间存在氢键,分子间作用力大,因而易液化,
故答案为:氨分子间存在氢键,分子间作用力大,因而易液化;
②W为H2O,中心原子氧原子含有孤对电子为$\frac{6-1×2}{2}$=2、价层电子对数为2+2=4,故水分子的VSEPR模型的空间构型为四面体形,
故答案为:四面体形;
③CN-离子与N2互为等电子体,二者结构相似,故其电子式为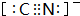 ,故答案为:
,故答案为: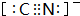 .
.
点评 本题水对物质结构与性质的考查,涉及氢键、杂化轨道、价层电子对互斥理论、电子式书写等,关键是熟记物质的组成推断元素,注意对基础知识的全面掌握.


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:选择题
| A. | CO32-、OH-、Na+、H+ | B. | Al3+、Na+、Cl-、AlO2- | ||
| C. | Ba2+、HCO3-、K+、SO42- | D. | S2-、H+、SO42-、Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
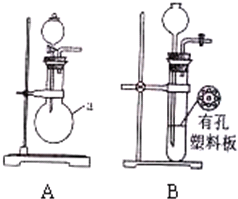 (1)用A装置制SO2,化学反应方程式为Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑.
(1)用A装置制SO2,化学反应方程式为Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
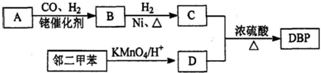

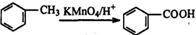


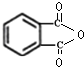 .
.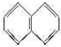 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 2molSO2、1molO2 | 4molSO3 |
| 平衡时n(SO3)/mol | 1 | m |
| 反应物的转化率 | α1 | α2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F、G 原子序数依次增大,A 与 B 不同周期,基态 B 原子核外电子占据 3 个能级,每个能级上电子数相等.D 能形成两种阴离子且电子总数分别为 10、18.E 是短周期电负性最强的元素.基态 F 的价层电子排布式为 ns xnp y,有 n=x+y.基态的+1 价 G 离子核外电子恰好排满三个电子层.
A、B、C、D、E、F、G 原子序数依次增大,A 与 B 不同周期,基态 B 原子核外电子占据 3 个能级,每个能级上电子数相等.D 能形成两种阴离子且电子总数分别为 10、18.E 是短周期电负性最强的元素.基态 F 的价层电子排布式为 ns xnp y,有 n=x+y.基态的+1 价 G 离子核外电子恰好排满三个电子层.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14 g乙烯和丙烯的混合物中总原子数为2NA个 | |
| B. | 在1mol的CH5+中所含的电子数为10NA | |
| C. | 16g CH4与18 g NH4+ 所含质子数相等 | |
| D. | 11.2 L的甲烷气体含有甲烷分子数一定为0.5NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原始社会人类学会利用火,他们以天然气取暖,吃熟食,从事生产活动 | |
| B. | 目前我国广大农村生活做饭使用的都是氢能源 | |
| C. | 多能源时代指的是新能源时代,包括核能、太阳能、氢能 | |
| D. | 化石燃料的燃烧没有污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:
在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:| A. | 在T2时,若反应体系处于状态D,则此时v正>v逆 | |
| B. | 若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2 | |
| C. | 若状态B、C、D的压强分别为PB、PC、PD,则 PC=PD>PB | |
| D. | 该反应的△H>0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com