
| 实验变量实验序号 | 银氨溶液 的量/ml | 乙醛的量 /滴 | 水浴温度 /℃ | 反应混合 液的PH | 出现银镜的 时间/min |
| 1 | 2 | 3 | 50 | 11 | T1 |
| 2 | 2 | 3 | 65 | 11 | T2 |
| 3 | 2 | 5 | 65 | 11 | T3 |
| 4 | 2 | 5 | 65 | 4 | 无银镜 |
| 5 | 2 | 5 | 65 | 10 | T4 |
| 6 | 4 | 3 | 50 | 10 | T5 |
| △ |
| △ |


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
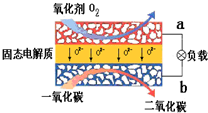 (1)有A、B、C、D四种金属,已知:只有D投入水中可与水剧烈反应;用B和C作电极,稀硫酸作电解质溶液构成原电池时,C为正极;A和C的离子共存于电解液中,以石墨为电极电解时阴极析出A.则这四种金属的活动性由强到弱的顺序是
(1)有A、B、C、D四种金属,已知:只有D投入水中可与水剧烈反应;用B和C作电极,稀硫酸作电解质溶液构成原电池时,C为正极;A和C的离子共存于电解液中,以石墨为电极电解时阴极析出A.则这四种金属的活动性由强到弱的顺序是查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验操作 | 实验现象或 预期实验现象 | 现象解释(用 离子方程式表示) | |
| 猜想② | 溶液pH=8 | ||
| 向pH=2的硫酸中 滴加Na2S2O3溶液 | 2S2O32-+2H+══S↓+SO2↑+H2O | ||
| 猜想③ | 向新制氯水中滴加少量Na2S2O3溶液 | 氯水颜色变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
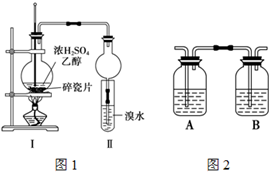 某化学兴趣小组用如图1所示装置进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性.当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色.
某化学兴趣小组用如图1所示装置进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性.当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、MnO4-、Cl-、Ba2+ |
| B、Na+、Ba2+、HCO3-、NO3- |
| C、K+、NO3-、CO32-、Cl- |
| D、Na+、H+、Cl-、S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
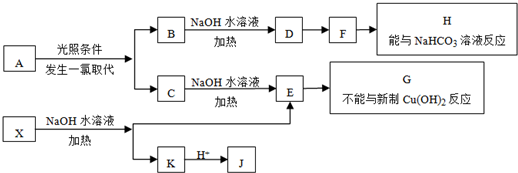
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀HCl |
| B、BaCl2 溶液 |
| C、AgNO3溶液 |
| D、稀HNO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com