
 无水三氯化铁易升华,有强烈的吸水性,是一种用途比较广泛的盐.
无水三氯化铁易升华,有强烈的吸水性,是一种用途比较广泛的盐.
分析 (1)氯化铁人员占得到溶质固体可以通过蒸发浓缩,冷却结晶,过滤洗涤得到晶体,在氯化氢气流中加热失去结晶水,抑制铁离子的水解得到固体氯化铁;
(2)根据Ksp[Fe(OH)3]=c(Fe3+)•c3(OH)计算;
(3)①酸化FeCl3用盐酸酸化,不引入杂质;
②萃取是利用溶质在不同溶剂中的溶解度差异分离提取物质的一种方法,能萃取说明FeCl3在异丙醚中的溶解度大于其在水中的溶解度;检验Fe3+用KSCN溶液效果最好;
③洗涤是除去沉淀表面杂质,冰水是减少沉淀溶解损失;故答案为:除去杂质、减少草酸铁晶体的溶解损耗;
④KMnO4标准溶液具有强氧化性,应置于酸式滴定管中;根据高锰酸钾的量计算草酸的含量,
a.没有润洗导致高锰酸钾浓度低消耗体积多;
b.读数高锰酸钾体积多;
c.读数体积偏小,结果偏低.
解答 解:(1)实验室中可将FeCl3溶液蒸发浓缩,冷却结晶,过滤洗涤得到氯化铁晶体FeCl3•6H2O,将FeCl3•6H2O在HCl的气氛中加热,抑制铁离子水解脱水得到无水FeCl3.
故答案为:蒸发(浓缩)、冷却(结晶);将FeCl3•6H2O在HCl的气氛中加热脱水;
(2)溶液pH为4时,c(OH)=10-10,根据Ksp[Fe(OH)3]=c(Fe3+)•c3(OH),可知c(Fe3+)=$\frac{Ksp[Fe(OH){\;}_{3}]}{{c}^{3(}OH)}$=$\frac{1.1×10{\;}^{-36}}{1{0}^{-10×3}}$mol/L=1.1×10-6 mol/L,
故答案为:1.1×10-6;
(3)①酸化FeCl3用盐酸酸化,不引入杂质,且抑制铁离子的水解,
故答案为:(浓)盐酸;
②萃取是利用溶质在不同溶剂中的溶解度差异分离提取物质的一种方法,能萃取说明FeCl3在异丙醚中的溶解度大于其在水中的溶解度;检验Fe3+用KSCN溶液效果最好,
故答案为:FeCl3在异丙醚中的溶解度大于其在水中的溶解度;取少量溶液,向其中滴加少量KSCN溶液,若溶液变红,则含有Fe3+;
③洗涤是除去沉淀表面杂质,冰水是减少沉淀溶解损失,
故答案为:除去杂质、减少草酸铁晶体的溶解损耗;
④KMnO4标准溶液具有强氧化性,应置于酸式滴定管中;
a.没有润洗导致高锰酸钾浓度低消耗体积多,偏高;
b.读数高锰酸钾体积多,偏高;
c.读数体积偏小,结果偏低,正确;
故答案为:甲;c.
点评 本题考查盐类水解盐类分析,草酸铁晶体[Fe2(C2O4)3•5H2O]的制备,涉及试验流程问题,根据物质的性质进行分析处理,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 元素性质 | 元素编号 | |||||||
| A | B | C | D | E | F | G | H | |
| 氢化物的沸点(℃) | -60.7 | -33.4 | -111.5 | 100 | -87.7 | 19.54 | -84.9 | -161.5 |
| 最高化合价 | +6 | +5 | +4 | +5 | +7 | +4 | ||
| 最低化合价 | -2 | -3 | -4 | -2 | -3 | -1 | -1 | -4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | ①②③⑤ | B. | ②③④① | C. | ④③⑤① | D. | ⑤③④① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫气体能用浓硫酸干燥,是因为二氧化硫无还原性 | |
| B. | 医疗上可用硫酸钡作X射线透视肠胃的内服药,是因为硫酸钡不溶于盐酸 | |
| C. | 向50 mL 18 mol•L-1的H2SO4溶液中加入足量的铜片加热充分反应后,被还原的H2SO4的物质的量等于0.45 mol | |
| D. | 常温下,浓H2SO4可以用铝制容器贮存,说明铝与浓H2SO4不反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
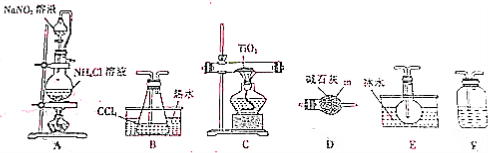
| 物质 | 熔点/℃ | 沸点/℃ | 其它 |
| CCl4 | -23 | 76 | 与 TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾,加热时能被氧气氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 步骤①需要使用普通漏斗 | B. | 步骤②要使用分液漏斗 | ||
| C. | 步骤③要用到坩埚 | D. | 步骤④需要蒸馏装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:2H2(g)+CO(g)?CH3OH(g)△H<0
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:2H2(g)+CO(g)?CH3OH(g)△H<0查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com