
| A. | 48.2% | B. | 33.6% | C. | 29.4% | D. | 无法计算 |
分析 同温同压下H2、O2、Cl2按9:4:1的体积比混合,同温同压下,气体体积之比等于物质的量之比,所以H2、O2、Cl2的物质的量之比为9:4:1,设它们的物质的量分别是9mol、4mol、1mol,发生的反应为:2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O、Cl2+H2$\frac{\underline{\;点燃\;}}{\;}$2HCl,根据方程式知,氧气完全反应需要8mol氢气,剩余的1mol氢气和1mol氯气恰好反应生成2molHCl,则溶质为HCl,溶剂为H2O,根据原子守恒得n(HCl)=2n(Cl2)=2mol,m(HCl)=2mol×36.5g/mol=73g,n(H2O)=4n(O2)=8mol,m(H2O)=8mol×18g/mol=144g,溶液质量=m(H2O)+m(HCl)=144g+73g=217g,据此分析解答.
解答 解:同温同压下H2、O2、Cl2按9:4:1的体积比混合,同温同压下,气体体积之比等于物质的量之比,所以H2、O2、Cl2的物质的量之比为9:4:1,设它们的物质的量分别是9mol、4mol、1mol,
发生的反应为2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O、Cl2+H2$\frac{\underline{\;点燃\;}}{\;}$2HCl,根据方程式知,氧气完全反应需要8mol氢气,剩余的1mol氢气和1mol氯气恰好反应生成2molHCl,则溶质为HCl,溶剂为H2O,
根据原子守恒得:n(HCl)=2n(Cl2)=2mol,m(HCl)=2mol×36.5g/mol=73g,n(H2O)=4n(O2)=8mol,m(H2O)=8mol×18g/mol=144g,溶液质量为:m(H2O)+m(HCl)=144g+73g=217g,
则溶液质量分数为:$\frac{73g}{217g}$×100%=33.6%,
故选B.
点评 本题考查混合物的有关计算、溶质质量分数的计算,题目难度中等,侧重考查学生分析计算能力,明确各个物理量之间的关系即可解答.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 容量瓶不能作为反应器皿,但是当溶液配制完后,可以用来存放配制的试剂 | |
| B. | 容量瓶不可以用来溶解固体,但是可以用来稀释浓硫酸等浓溶液 | |
| C. | 配制450 mL的溶液时可以用100mL和50mL规格的容量瓶分多次进行配制 | |
| D. | 定容后凹液面最低点与刻度线相切、摇匀后发现凹液面最低点比刻度线要低,无需做任何处理 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝片和稀硫酸反应 | B. | Ba(OH)2•8H2O与NH4Cl反应 | ||
| C. | 灼热的碳与二氧化碳反应 | D. | 甲烷在氧气中燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ② | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1 | B. | 0.15mol•L-1 | C. | 0.2mol•L-1 | D. | 0.25mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2O | B. | NO | C. | NH4NO3 | D. | N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加聚反应也可能有水生成 | |
| B. | 水、乙醇、氢氧化钠中都存在羟基 | |
| C. | 王水、溴水、水银、水晶中均含有“H2O” | |
| D. | 在某些有机反应中,水可能是反应物也可能是生成物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
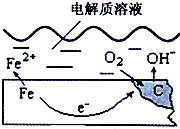 如图是钢铁在潮湿空气里发生电化学腐蚀原理示意图,发生的反应为:
如图是钢铁在潮湿空气里发生电化学腐蚀原理示意图,发生的反应为:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com