
【题目】组成和结构可用 表示的有机物共有(不考虑立体结构)( )
表示的有机物共有(不考虑立体结构)( )
A. 24种B. 28种C. 32种D. 36种
科目:高中化学 来源: 题型:
【题目】海洋是资源的宝库,具有十分巨大的开发潜力。工业上从海水提取金属镁的流程如下:
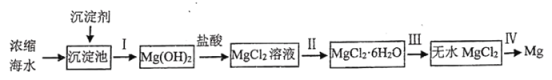
回答下列问题:
(1)沉淀剂是________________(填化学式),不选用同类的其他物质的理由是_______________。
(2)下列选项中,涉及的操作包含操作Ⅰ的是___________。
A 实验室从溴水中提取溴单质
B 除去![]() 固体中的少量NaCl
固体中的少量NaCl
C 从![]() 分解产物中获得
分解产物中获得![]()
D 用工业酒精制无水乙醇
(3)在进行步骤Ⅱ时,如果没有加入盐酸,可能产生的杂质是______________(填化学式)。
(4)一种模拟工业用![]() 制无水
制无水![]() 的实验室设计如下:
的实验室设计如下:
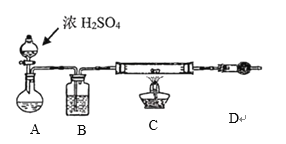
装置A中盛放液体是______________,装置D的作用是____________________________。
(5)步骤Ⅳ发生反应的化学方程式是___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据杂化轨道理论和价电子对互斥模型判断,下列分子或者离子的中心原子杂化方式及空间构型正确的是( )
选项 | 分子或离子 | 中心原子杂化方式 | 价电子对互斥模型 | 分子或离子的立体构型 |
A. | SO2 | sp | 直线形 | 直线形 |
B. | HCHO | sp2 | 平面三角形 | 三角锥形 |
C. | NF3 | sp2 | 四面体形 | 平面三角形 |
D. |
| sp3 | 正四面体形 | 正四面体形 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用氢氧化钠固体配制溶液的过程:称取10.0 g氢氧化钠固体,在烧杯中加水搅拌溶解后,用如图所示的容量瓶来配制氢氧化钠溶液,回答下列问题:
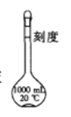
(1)______(填“能”或“不能”)将溶解后的氢氧化钠立即转移到容量瓶中。
(2)所配制的氢氧化钠溶液的物质的量浓度是_______molL-1.
(3)取出所配制的溶液10 mL,加水稀释至500 mL,稀释后溶液溶质的物质的量浓度是_______mol L-1.
(4)将CO2通入氢氧化钠溶液(过量)中,写出发生反应的化学方程式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用含碳化合物合成燃料是解决能源危机的重要方法,已知CO(g)+2H2(g)![]() CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是 ( )
CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是 ( )

A. 该反应的ΔH=+91 kJ·mol-1
B. 加入催化剂,该反应的ΔH变小
C. 反应物的总能量小于生成物的总能量
D. 如果该反应生成液态CH3OH,则ΔH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝基苯是重要的精细化工原料,是医药和染料的中间体,还可作有机溶剂.实验室中制备硝基苯的过程如下:
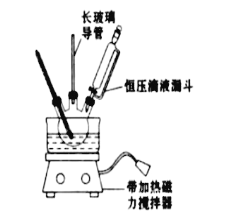
①配制混酸:组装如图反应装置.取100mL烧杯,用20mL浓硫酸与18mL浓硝酸配制混合酸,加入恒压滴液漏斗中.把18mL苯加入三颈烧瓶中.
②向室温下的苯中逐滴加入混酸,边滴边搅拌,混合均匀.
③加热在50~60℃下发生反应,直至反说结束.
④除去混合酸后,粗产品依次用蒸馏水和10%Na2CO3溶液洗涤,最后用蒸馏水洗涤得到粗产品.
⑤为了得到更纯净的硝基苯.还需先向液棒中加入试剂A,静置一段时间后弃去试剂A,然后蒸馏,最终得到17.5g硝基苯
已知:

可能用到的有关数据列表如下:

请回答下列问题:
(1)配制混酸应先在烧杯中加入_______.
(2)恒压滴液漏斗的优点是_______,实验装置中长玻璃导管可用____________代替(填仪器名称)
(3)要控制反应温度50~60℃,可用水浴加热,其优点为___________________________
(4)反应结束后产品在液体的_____层(填"上"或"下"),分离混酸和产品的操作方法为____________
(5)用10% Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净?___________
(6)试剂A是________,蒸馏过程中需在蒸馏烧瓶中加入沸石,其作用为_______________若加热后,发现未加沸石,应采取的正确方法______________________________________
(7)硝基苯的产率为_________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中进行的可逆反应:aA(g)+bB(g)![]() cC(g)在不同温度(T1和T2)及压强(p1和p2)下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示。下列判断正确的是
cC(g)在不同温度(T1和T2)及压强(p1和p2)下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示。下列判断正确的是

A.T1<T2,p1<p2,a+b>c,正反应为吸热反应
B.T1>T2,p1<p2,a+b<c,正反应为吸热反应
C.T1<T2,p1>p2,a+b<c,正反应为吸热反应
D.T1>T2,p1>p2,a+b>c,正反应为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用密度为1.18 g/mL,质量分数为36.5%浓盐酸配制250 mL 0.1 mol/L的盐酸溶液,填空并请回答下列问题:
(1)配制250 mL 0.1 mol/L的盐酸溶液,需要量取浓盐酸的体积是_____mL(精确到0.1);
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)____________;
A.用30 mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需的浓盐酸,沿玻璃棒倒入烧杯中,再加入少量水(约30 mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250 mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2 cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是_________,溶液注入容量瓶前需恢复到室温,这是因为__________。
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)?若没有进行A操作________;若加蒸馏水时不慎超过了刻度________;若定容时俯视刻度线________。
(5)若实验过程中出现如下情况如何处理?
加蒸馏水时不慎超过了刻度____________;
向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列事实能说明醋酸是弱电解质的组合是__________(填序号)。
①醋酸与水能以任意比互溶 ②用醋酸溶液做导电实验,灯泡很暗
③醋酸溶液中存在醋酸分子 ④0.1 mol/L醋酸溶液的pH为4
⑤醋酸能和碳酸钙反应放出CO2
(2)已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)的值增大,可以采取的措施是____________(填序号)
CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)的值增大,可以采取的措施是____________(填序号)
①加少量烧碱溶液 ②升高温度 ③加少量冰醋酸 ④加水
(3)在一定温度下,有a.盐酸 b.硫酸 c.醋酸 三种酸:
①当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是________。(用序号表示,下同)
②同体积、同物质的量浓度的三种酸,中和NaOH的能力由大到小的顺序是________。
③当三者c(H+)相同且体积也相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则开始时反应速率的大小关系为________,反应所需时间的长短关系是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com