
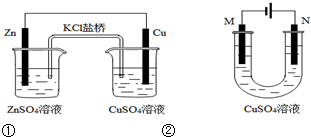
| A. | 装置①中盐桥内的K+移向CuSO4溶液 | |
| B. | 装置①将电能转变为化学能 | |
| C. | 若装置②用于铁棒镀铜,则N极为铁棒 | |
| D. | 若装置②用于电解精炼铜,则N极为粗铜 |
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡是中心原子采取sp3杂化的分子,其立体构型都是正四面体型 | |
| B. | 在SCl2中,中心原子S采取sp杂化轨道成键 | |
| C. | 杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对 | |
| D. | 凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定存在的离子为Fe3+、SO42- | |
| B. | 一定不存在的离子为CO32-、I- | |
| C. | 不能确定的离子为K+、SO42- | |
| D. | 确定是否含有K+离子需要经过焰色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质发生化学变化都伴随着能量变化 | |
| B. | 任何反应中的能量变化都表现为热量变化 | |
| C. | 伴有能量变化的物质变化都是化学变化 | |
| D. | 所有化学反应都可以设计成原电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2 NA | |
| B. | 4.2 g C3H6中含有的碳碳双键数一定为0.1 NA | |
| C. | 1 mol-OH中电子数为10 NA | |
| D. | 标准状况下,2.24 L CHCl3的原子总数为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用澄清石灰水区别SO2和CO2 | |
| B. | 用酸性KMnO4溶液区分苯和乙烯 | |
| C. | 用新制Cu(OH)2悬浊液区分蔗糖和葡萄糖 | |
| D. | 用加热的方式区别碳酸钠和碳酸氢钠 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com