
| 溶质 | 实验步骤 | 实验现象 | 离子方程式 |
| SO42- |
| n |
| V |
| n |
| V |
| n |
| V |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
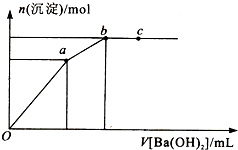 向100mL 0.1mol?L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液中逐滴滴入0.1mol?L-1Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如下图所示.则下列说法中正确的是( )
向100mL 0.1mol?L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液中逐滴滴入0.1mol?L-1Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如下图所示.则下列说法中正确的是( )| A、a点时溶液中所含主要溶质为(NH4)2SO4 |
| B、a→b段发生反应的离子方程式是:SO42-+Ba2+=BaSO4↓ |
| C、b点为最大沉淀量,对应的纵坐标值为0.2 |
| D、c点加入Ba(OH)2溶液的体积为200 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将此溶液稀释106倍,溶液的pH=6 |
| B、与等体积等浓度的氯化铵溶液混合后所得溶液呈中性 |
| C、与pH=2的CH3COOH溶液任意比混合:c(H+)+c(Na+)=c(OH-)+c(CH3COO-) |
| D、与0.01 mol?L-1 的CH3COOH溶液等体积混合所得溶液中:c (Na+)>c(CH3COO-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| A、由重晶石制备高纯BaSO4只需经过两步化学反应 | ||||
B、反应C(g)+CO2(g)
| ||||
| C、实际生产中必须加入过量的炭使BaSO4得到充分的还原,同时还要通入空气,因为①②为吸热反应,炭和氧气反应放热维持反应所需高温 | ||||
| D、以BaS作为沉淀剂,用于铅和汞沉淀的转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、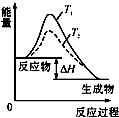 温度T1>T2,SO2与O2反应过程中的能量变化 |
B、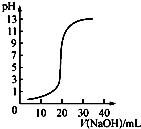 表示0.100 0 mol/L NaOH溶液滴定20.00 mL 0.100 0 mol/L CH3COOH溶液 |
C、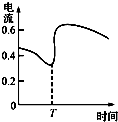 表示Zn、Cu和稀硫酸构成的原电池中电流强度的变化,T时加入了H2O2 |
D、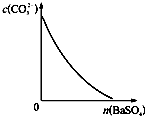 表示在饱和Na2CO3溶液中逐步加BaSO4固体后,溶液中c(CO32-)的浓度变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (Ⅰ)(石油是现代工业的血液,乙烯的年产量可以衡量一个国家石油化工发展水平.请回答下列问题.
(Ⅰ)(石油是现代工业的血液,乙烯的年产量可以衡量一个国家石油化工发展水平.请回答下列问题.| 催化剂 |
| Ⅰ |
| Ⅱ |
| Ⅲ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、②③ |
| C、②③① | D、③② |
查看答案和解析>>
科目:高中化学 来源: 题型:
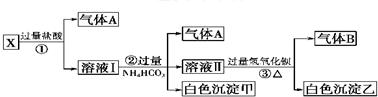
| A、气体A能使湿润的红色石蕊试纸变蓝,气体B能使湿润的蓝色石蕊试纸变红 |
| B、白色沉淀甲是混合物,白色沉淀乙是纯净物 |
| C、Ag+、Ba2+、Al3+、MnO4-、SO42-一定都不存在于溶液中 |
| D、Na+、AlO2-、CO32-一定存在于溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2912 kJ |
| B、2953 kJ |
| C、3236 kJ |
| D、3867 kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com