
【题目】取NaCl和KCl的混合物25g,溶于水配成溶液,加入体积为1L 0.42mol·L-1的AgNO3溶液,充分反应后过滤出沉淀,再向滤液中加入100gCu片,反应完全后,取出Cu片,洗涤干燥称其重量为101.52g,求原混合物中NaCl和KCl的物质的量各为多少?
【答案】n(NaCl)=0.3mol n(KCl)=0.1mol
【解析】
题目中给出的AgNO3的物质的量一定,又知加入AgNO3后溶液中的Cl-完全沉淀后,加入铜片质量增加,说明AgNO3过量,只有通过Cu片增加部分求过量的AgNO3,然后再通过AgNO3总物质的量减去过量的AgNO3,剩余AgNO3为产生沉淀的部分,就可以推出NaCl、KCl各自的物质的量。
(1)AgNO3的物质的量为:1L×0.42mol·L-1=0.42mol;
(2)设与Cu反应的硝酸银的物质的量为x
Cu+2AgNO3=Cu(NO)3+2Ag △m
64 2mol(2×170) 216 216-64=152
x 101.52-100=1.52g
![]() ,解得x=0.02mol
,解得x=0.02mol
(3) 根据反应NaCl +AgNO3=AgCl↓+NaNO3、KCl +AgNO3 =AgCl↓+KNO3,则有
n(NaCl)+n(KCl)= 0.42mol -0.02mol=0.40mol,n(NaCl)×58.5g/mol+n(KCl)×74.5g/mol=25g,解得: n(NaCl)=0.3mol 、n(KCl)=0.1mol。


科目:高中化学 来源: 题型:
【题目】米饭遇到碘酒时显蓝色,咀嚼米饭后有甜味,这说明( )
A. 米饭中只含有淀粉 B. 米饭咀嚼后只含单糖
C. 米饭咀嚼时单糖聚合成淀粉 D. 米饭咀嚼时淀粉发生了水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R 代表)。回答下列问题:
(1)基态N 原子中,核外电子占据的最高能层的符号是______________,占据该能层电子的电子云轮廓图形状为_______________________________。
(2)N 和O 两种元素第一电离能大小关系是N__________( 填“ >”“ <” 或“ =” )O,其原因是____________;N 和O两种元素电负性大小关系是N_______(填“ >”“ <” 或“=” )O。
(3)经X-射线衍射测得化合物R 的晶体结构,其局部结构如下图所示。

①组成化合物R 的两种阳离子中σ键的个数之比为_________;其中四核阳离子的立体构型为___________,其中心原子的杂化轨道类型是_______________________。
②分子中的大π键可用符号![]() 表示,其中m 代表参与形成的大π键原子数,n 代表参与形成的大π键电子数,如苯分了中的大π键可表示为
表示,其中m 代表参与形成的大π键原子数,n 代表参与形成的大π键电子数,如苯分了中的大π键可表示为![]() 。则N5-中的大π键应表示为___________________。
。则N5-中的大π键应表示为___________________。
③氢键通常用X-H…···Y 表示,请表示出上图中的所有氧键:_________________。
④R的立方晶胞参数为a nm,晶胞中含有Y个(N5)6(H3O)3(NH4)4Cl 单元,如果(N5)6(H3O)3(NH4)4Cl的相对分子质量用M 表示,阿伏加德罗常数的值为NA,则R 晶体的密度为________g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,即属于非氧化还原反应同时又是吸热反应的是( )
A.Ba(OH)2.8H2O与NH4Cl反应B.灼热的炭与CO2反应
C.铝与稀盐酸D.H2与O2的燃烧反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(16分)止咳酮(F)具有止咳、祛痰作用。其生产合成路线如下:
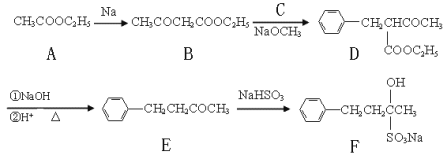
(1)写出B中含有的官能团名称: 。
(2)已知B→D反应属于取代反应,写出C(C属于氯代烃)的结构简式: 。
(3)写出E→F的反应类型: 。
(4)满足下列条件的E的同分异构体有 种。
①苯环上有两个邻位取代基; ②能与FeCl3溶液发生显色反应;
③除苯环外不含其它的环状结构。
(5)写出A→B的反应方程式: 。
(6)A→F六种物质中含有手性碳原子的是: (填物质代号)。
(7)目前我国用粮食发酵生产丙酮(CH3COCH3)占较大比重。利用题给相关信息,以淀粉为原料,合成丙酮。合成过程中无机试剂任选。
提示:合成路线流程图示例如下:
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和碘、氮的相关化合物在化工、材料等领域有着广泛的应用。回答下列问题:
(1)基态Fe原子中,核外未成对电子数为________个,铁的第三电离能I3(Fe)比锰的第三电高能I3(Mn)小其原因是__________________________________________________。
(2)NaNO2可用作肉类食品的发色剂,阴离子NO2-的几何构型为_________,中心原子的杂化轨道类型为_________。
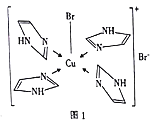
(3)Cu2+的一种配合物的分子结构如图1所示,配位原子为________,配体![]() 分子中σ键总数为________个,分子中的大π键可用符号
分子中σ键总数为________个,分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() ),则
),则![]() 中的大π键应表示为________________。
中的大π键应表示为________________。

(4)一种铁的氧化物由不同价态的铁原子[Fe(A)和Fe(B)]与氧原子构成,其晶胞内部有图示Ⅰ、Ⅱ两种结构,晶胞的部分结构如图2。
①该铁的氧化物的化学式为_________,其熔点为1594.5 ℃,则它属于_________ (填“原子”“离子”或“分子”)晶体。
②该晶胞边长为a pm,则其密度为____________________g·cm-3(列出表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiOH和钴氧化物可用于制备锂离子电池正极材料。利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。下列说法不正确的是( )

A. B极区电解液为LiOH溶液
B. 电解过程中Li+向B电极迁移
C. 每产生标准状况下2.24L氢气,就有0.1mol阳离子通过交换膜进入阴极区
D. 阳极电极反应式为2Cl- - 2e-=Cl2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com