
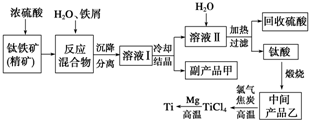
 金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀等性质被广泛用在高新科技材料和航天领域中.
金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀等性质被广泛用在高新科技材料和航天领域中.分析 由流程可知,钛铁矿(主要成分是:FeTiO3,还含有少量Mn、Zn、Cr、Cu等重金属元素及脉石等杂质)中加入浓硫酸,FeTiO3发生反应:FeTiO3+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$TiOSO4(硫酸氧钛)+FeSO4+2H2O,钛铁矿和浓硫酸反应的产物之一是TiOSO4,加入铁屑,可防止Fe2+氧化,溶液Ⅰ中含有FeSO4和TiOSO4,溶液Ⅱ主要含有TiOSO4,加入水,加热可水解生成H2TiO3,经煅烧可生成TiO2,用氯气、碳反应可生成TiCl4,高温条件下与镁反应可生成Ti,
(1)根据流程可知副产品甲为FeSO4•7H2O,可循环利用的物质是硫酸;
(2)铁能够与铁离子反应,加入铁粉可防止铁离子氧化;
(3)乙为TiO2,反应物为乙为TiO2、氯气、C,反应产物为四氯化钛和CO,反应条件为高温,据此写出反应的化学方程式;
(4)根据元素守恒可知,镁和TiCl4反应可得钛和氯化镁,据此写化学方程式,钛能被氧化;
(5)“硫酸法”排放的废液为酸性,会产生酸污染;与Ti共存的其它重金属的废液对水体有污染,可以用熟石灰治理污染.
解答 解:钛铁矿(主要成分是:FeTiO3,还含有少量Mn、Zn、Cr、Cu等重金属元素及脉石等杂质)中加入浓硫酸,FeTiO3发生反应:FeTiO3+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$(浓)TiOSO4(硫酸氧钛)+FeSO4+2H2O,钛铁矿和浓硫酸反应的产物之一是TiOSO4,加入铁屑,可防止Fe2+氧化,溶液Ⅰ中含有FeSO4和TiOSO4,溶液Ⅱ主要含有TiOSO4,加入水,加热可水解生成H2TiO3,经煅烧可生成TiO2,用氯气、碳反应可生成TiCl4,高温条件下与镁反应可生成Ti,
(1)从流程图硫酸与过量的铁反应可知,副产品甲是FeSO4•7H2O,可循环利用的物质是硫酸,
故答案为:FeSO4•7H2O;硫酸;
(2)铁可与Fe3+反应生成Fe2+,加入铁屑,可防止Fe2+氧化,离子方程式为2Fe3++Fe=3Fe2+,
故答案为:2Fe3++Fe=3Fe2+;
(3)中间产物乙为TiO2,TiO2与焦炭、氯气在高温下发生反应生成四氯化钛和一氧化碳,反应的方程式为:TiO2+2Cl2+2C$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO,
故答案为:TiO2+2Cl2+2C$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO;
(4)根据元素守恒可知,镁和TiCl4反应可得钛和氯化镁,化学方程式为2Mg+TiCl4$\frac{\underline{\;高温\;}}{\;}$Ti+2MgCl2,钛能被氧化,所以稀有气体氛围能防止钛被氧化,
故答案为:2Mg+TiCl4$\frac{\underline{\;高温\;}}{\;}$Ti+2MgCl2;防止钛被氧化;
(5)硫酸法生产钛排放的废液为酸性,会产生酸污染,并且与Ti共存的其它重金属的废液对水体有污染,
故答案为:①酸污染 ②重金属离子(Cu2+、Cr3+等)污染.
点评 本题考查物质的制备实验方案的设计,题目难度中等,试题侧重于学生的分析能力和实验能力的考查,为高考常见题型,明确制备流程及反应原理为解答关键,注意把握实验的基本原理和常见物质的性质.


 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:填空题
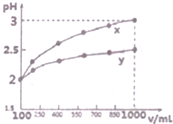 (1)现有浓度为0.1mol•-1的四种溶液①硫酸②醋酸③氢氧化钠④氯化铵.这四种溶液中由水电离出的H+浓度由大到小的顺序是④②③①(填序号).
(1)现有浓度为0.1mol•-1的四种溶液①硫酸②醋酸③氢氧化钠④氯化铵.这四种溶液中由水电离出的H+浓度由大到小的顺序是④②③①(填序号).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
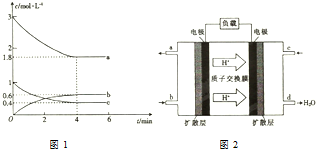 甲醇是一种低碳能源,在全球能源危机和环境污染的背景下具有良好的发展前景,在催化剂作用下可用H2(g)+CO(g)$\stackrel{催化剂}{?}$CH3OH(g),三种物质的物质的量浓度随时间变化的关系如图1所示.
甲醇是一种低碳能源,在全球能源危机和环境污染的背景下具有良好的发展前景,在催化剂作用下可用H2(g)+CO(g)$\stackrel{催化剂}{?}$CH3OH(g),三种物质的物质的量浓度随时间变化的关系如图1所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
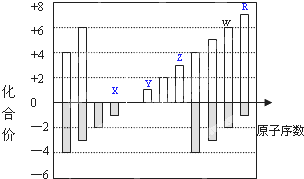 如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )| A. | Y和Z两者最高价氧化物对应的水化物能相互反应 | |
| B. | 气态氢化物的稳定性:W>R | |
| C. | WO3和水反应形成的化合物是离子化合物 | |
| D. | 原子半径:Z>Y>X |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
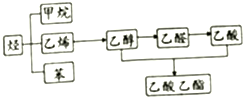 如图是几种重要的有机物及部分转化关系,请回答下列问题:
如图是几种重要的有机物及部分转化关系,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
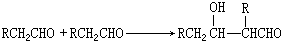
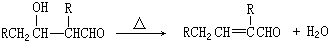
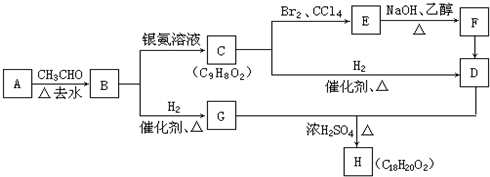
 ;
; +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$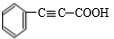 +2NaBr+2H2O
+2NaBr+2H2O +
+ $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$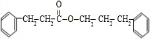 +H2O.
+H2O.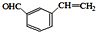 、
、 、
、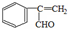
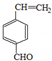 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食品保鲜膜、一次性食品袋的主要成分是聚氯乙烯 | |
| B. | 工业燃煤中加入适量的生石灰能有效减少二氧化硫的排放量 | |
| C. | 若同时使用硫酸亚铁和氯气处理水,能达到消毒杀菌和除去悬浮杂质的目的 | |
| D. | 航天服的主要成分是碳化硅、陶瓷和碳纤维,它们都属于无机非金属材料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com