
| A. | 硬铝 | B. | 青铜 | C. | 不锈钢 | D. | 水银 |
分析 根据合金的定义与特点进行解答.合金是指在一种金属中加热熔合其它金属或非金属而形成的具有金属特性的物质.合金概念有三个特点:①一定是混合物;②合金中各成分都是以单质形式存在;③合金中至少有一种金属.
解答 解:A.是指铝合金中以Cu为主要合金元素的(含2.2-4.9%Cu、0.2-1.8%Mg、0.3-0.9%Mn、少量的硅,其余部分是铝)一类 铝合金,故A不符合;
B.青铜是铜锡合金,故B不符合;
C.不锈钢是铁、镍、铬等金属形成的合金,故C不符合;
D,水银为金属汞,是金属单质不是合金,故D符合;
故选D.
点评 本题主要考查合金与合金的性质,合金概念的三个特点要记牢;本考点基础性强,比较好把握,题目难度不大.


科目:高中化学 来源: 题型:实验题
 某研究性学习小组为了探究醋酸的电离情况,进行了如下实验.
某研究性学习小组为了探究醋酸的电离情况,进行了如下实验.| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
| 醋酸浓度(mol/L) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
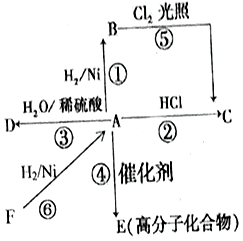 某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应.
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 单位时间内生成1 mol的H2,同时生成2 mol 的HI | |
| B. | 容器内的总压强不随时间的变化而变化 | |
| C. | 1mol I-I 键断裂的同时有2mol HI键形成 | |
| D. | 容器内气体颜色不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH+NaHCO3→Na2CO3+H2O | |
| B. | Ca(OH)2+Ca(HCO3)2→2CaCO3↓+2H2O | |
| C. | 2NaOH+NH4HCO3→NH3?H2O+Na2CO3+H2O | |
| D. | NaOH+Ca(HCO3)2→2CaCO3↓+H2O+NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com