
| A. | N2O结构式可表示为N=N=O | |
| B. | O3分子呈直线形 | |
| C. | CH2=CH-CHO分子中碳原子均采用sp2杂化 | |
| D. | 相同压强下,HCOOH沸点比CH3OCH3高,说明前者是极性分子,后者是非极性分子 |
分析 A.N20与CO2是等电子体,结构相似;
B.O3与SO2是等电子体,结构相似;
C.CH2=CH-CHO分子中每个碳原子均形成三根共价键,均采用sp2杂化;
D.HCOOH分子间能形成氢键;CH30CH3不能形成分子间氢键;
解答 解:A.N20与CO2是等电子体,CO2的结构式O=C=O,所以N20结构式可表示为N=N=O,故A正确;
B.O3与SO2是等电子体,SO2是V形分子,所以O3分子呈V形,故B错误;
C.CH2=CH-CHO分子中每个碳原子均形成三根共价键,均采用sp2杂化,故C正确;
D.HCOOH分子间能形成氢键;CH30CH3不能形成分子间氢键,所以相同压强下,HCOOH沸点比CH30CH3高,故D错误;
故选:AC.
点评 本题是道综合题,涉及的知识点有分子空间构型、等电子体的运用、化学键、杂化类型等,知识点多,但题目难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 0.05mol Na2O2固体中含有的阴离子数为0.05NA | |
| B. | 标准状况下,2.24L CH4所含的原子数为0.5NA | |
| C. | 1molSO2与足量O2在一定条件下反应,共转移2NA个电子 | |
| D. | 1L0.1mol•L-1氨水中含有的NH3•H2O分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | ① | |||||||
| 2 | ⑤ | ⑥ | ⑦ | |||||
| 3 | ② | ③ | ④ | ⑧ | ||||
| 4 | ⑨ | |||||||
| 5 | ⑩ |
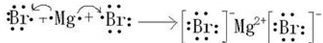 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1:l | B. | 1:1:2 | C. | 2:2:1 | D. | 4:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
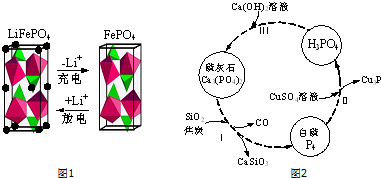
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
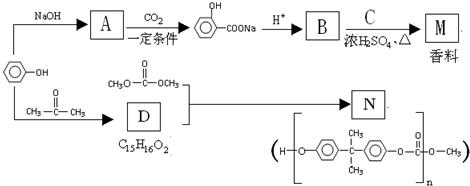
 +NaOH→
+NaOH→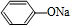 +H2O.
+H2O. ;
;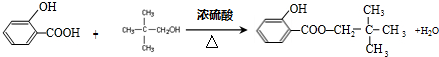 .
.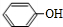 +
+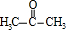 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$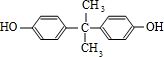 +H2O由D生成N的反应类型是缩聚反应
+H2O由D生成N的反应类型是缩聚反应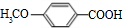 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 1 | 操作 | 现象 | 结 论 |
| A | 向白色AgCl悬浊液中滴加0.1mol/LKI溶液 | 试管中白色沉淀转化为黄色沉淀. | Ksp(AgCl)>Ksp(AgI) |
| B | 向装有Fe(NO3)2溶液的试管中加入几滴稀H2SO4 | 溶液颜色基本不变 | Fe(NO3)2与H2SO4不反应 |
| C | 向Na2SiO3溶液中滴加盐酸 | 溶液变浑浊 | 非金属性:Cl>Si |
| D | SO2通入足量的稀Fe(NO3)3溶液 | 溶液由棕黄色变为浅绿色,后立即又变成棕黄色 | 氧化性:HNO3>H2SO4>Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com