
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |


科目:高中化学 来源: 题型:
 H2S是一种无色、有毒的可燃性气体,其水溶液叫氢硫酸(二元弱酸).
H2S是一种无色、有毒的可燃性气体,其水溶液叫氢硫酸(二元弱酸).查看答案和解析>>
科目:高中化学 来源: 题型:
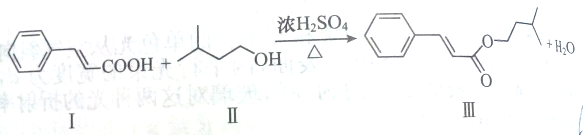
| A、Ⅱ物质的名称为2-甲基-4-丁醇 |
| B、Ⅲ物质的分子式为C14H18O2 |
| C、Ⅰ物质的9个碳原子一定共面 |
| D、Ⅲ物质中有3种官能团 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓硫酸有吸水性,可用于干燥氨气 |
| B、SiO2是酸性氧化物,能与NaOH溶液反应 |
| C、Na2O2与水反应、红热的Fe与水蒸气反应均能生成碱 |
| D、新制氯水显酸性,滴加少量紫色石蕊溶液,溶液始终呈红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某实验小组用MnO2与浓盐酸混合加热制取Cl2,并将制得的氯气与潮湿的Ca(OH)2固体反应制取少量漂白粉.实验装置如图:回答下列问题.
某实验小组用MnO2与浓盐酸混合加热制取Cl2,并将制得的氯气与潮湿的Ca(OH)2固体反应制取少量漂白粉.实验装置如图:回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3 (s) |
| B、(NH4)2SO4 (s) |
| C、K2SO4 (aq) |
| D、H2O (l) |
| E、CH3COONa(s) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
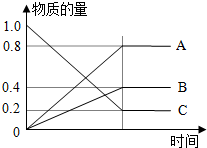
| t/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)/mol?L-1 | 5.0 | 3.8 | 3.0 | 3.0 |
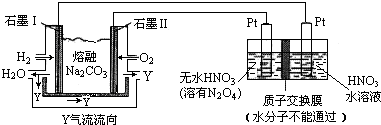
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com