
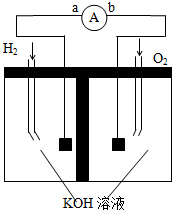
 氢氧燃料电池是符合绿色化学理念的新型电池,图为电池示意图,据此回答下列问题
氢氧燃料电池是符合绿色化学理念的新型电池,图为电池示意图,据此回答下列问题分析 (1)氢氧燃料碱性电池中,正极上O2得电子和H2O反应生成OH-;
(2)25℃、101kPa时,C2H6(g)的燃烧热为1559.8kJ/mol,即1mol乙烷完全燃烧生成二氧化碳气体和液态水放出1559.8kJ热量;
(3)甲烷燃料碱性电池中,负极上甲烷失电子和OH-反应生成CO32-和H2O;
(4)待镀金属上析出的是Cu,待镀金属的质量增加12.8g,则析出n(Cu)=$\frac{12.8g}{64g/mol}$=0.2mol,根据转移电子守恒计算消耗甲烷体积.
解答 解:(1)氢氧燃料碱性电池中,正极上O2得电子和H2O反应生成OH-,电极反应式为O2+4e-+2H2O=4OH-,故答案为:O2+4e-+2H2O=4OH-;
(2)25℃、101kPa时,C2H6(g)的燃烧热为1559.8kJ/mol,即1mol乙烷完全燃烧生成二氧化碳气体和液态水放出1559.8kJ热量,则C2H6(g)燃烧热的热化学方程式为C2H6(g)+$\frac{7}{2}$O2(g)=2CO2(g)+3H2O(l)△H=-1559.8KJ/mol,
故答案为:C2H6(g)+$\frac{7}{2}$O2(g)=2CO2(g)+3H2O(l)△H=-1559.8KJ/mol;
(3)甲烷燃料碱性电池中,负极上甲烷失电子和OH-反应生成CO32-和H2O,电极反应式为CH4-8e-+10OH-=CO32-+7H2O,故答案为:CH4-8e-+10OH-=CO32-+7H2O;
(4)待镀金属上析出的是Cu,待镀金属的质量增加12.8g,则析出n(Cu)=$\frac{12.8g}{64g/mol}$=0.2mol,根据转移电子守恒计算消耗甲烷体积=$\frac{0.2mol×2}{8}×22.4L/mol$=1.12L,
故答案为:1.12.
点评 本题考查燃料电池、电镀、热化学等知识点,明确各个电极上发生的反应及热化学方程式的书写方法是解本题关键,难点是电极反应式的书写,注意结合电解质溶液酸碱性书写,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-═Cl2↑ | |
| B. | NaHS水解:HS-+H2O?S2-+H3O+ | |
| C. | 在碱性介质中,氢氧燃料电池的负极反应式为:O2+4e-═2O2- | |
| D. | NaHCO3电离:NaHCO3?Na++HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 验证盐类的水解是否是吸热反应 | 向醋酸钠溶液中滴入酚酞试液,加热观察红色是否加深 |
| B | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红 |
| C | 验证Br2的氧化性强于I2 | 将少量溴水加入KI溶液中,再加入CCl4,振荡,静置,可观察到下层液体呈紫色 |
| D | 验证Fe(OH)3的溶解度小于Mg(OH)2 | 将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红褐色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlON和石英的化学键类型相同 | B. | 电解熔融AlON可得到Al | ||
| C. | AlON的N元素化合价为-1 | D. | AlON和石英晶体类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 该浓硝酸中HNO3的物质的量浓度是12.0 mol/L | |
| B. | 该合金中铜与镁的物质的量之比是2:1 | |
| C. | NO2和N2O4的混合气体中,N2O4的体积分数是20% | |
| D. | 得到2.54g沉淀时,加入NaOH溶液的体积是6.0 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
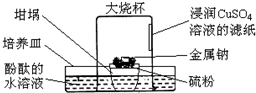 倒置的坩埚盖子上放入硫粉,在硫粉中央放一小块钠,按图示搭建装置.用胶头滴管向金属钠滴加一滴水,立即倒扣上大烧杯,发现坩埚盖子内火星四溅,烧杯内出现大量白烟,下列说法错误的是( )
倒置的坩埚盖子上放入硫粉,在硫粉中央放一小块钠,按图示搭建装置.用胶头滴管向金属钠滴加一滴水,立即倒扣上大烧杯,发现坩埚盖子内火星四溅,烧杯内出现大量白烟,下列说法错误的是( )| A. | 水是钠与硫反应的催化剂 | B. | 酚酞的水溶液变红色 | ||
| C. | 钠与硫的反应是放热反应 | D. | 滤纸逐渐变黑 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冰和水之间的相互转化是化学变化 | |
| B. | 溶于水能导电的化合物一定是电解质 | |
| C. | 碱性氧化物一定是金属氧化物 | |
| D. | 有单质生成的反应一定是氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com