
| 物质 | 选用试剂(过量) | 操作方法 | |
| A | Cu(CuO) | 氧气 | 通入氧气并加热 |
| B | CO2(HCl) | 氢氧化钠溶液 | 气体通过盛有氢氧化钠溶液的洗气瓶 |
| C | N2(O2) | 铜粉 | 气体通过炽热的铜粉 |
| D | KCl溶液(K2CO3) | 氯化钙溶液 | 加入氯化钙溶液充分反应后过滤 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.Cu与氧气加热下反应;
B.二者均与NaOH溶液反应;
C.Cu与氧气反应,Cu与氮气不反应;
D.氯化钙过量时引入新杂质.
解答 解:A.Cu与氧气加热下反应,将原物质反应掉,应选还原剂氢气、CO等除杂,故A错误;
B.二者均与NaOH溶液反应,不能除杂,应选饱和碳酸氢钠溶液、洗气来除杂,故B错误;
C.Cu与氧气反应,Cu与氮气不反应,则通过炽热的铜粉可除杂,故C正确;
D.氯化钙过量时引入新杂质,不符合除杂的原则,应选试剂为盐酸,故D错误;
故选C.
点评 本题考查混合物分离提纯的方法和选择,为高频考点,把握物质的性质、性质差异及发生的反应为解答的关键,侧重分析与应用能力的考查,注意除杂的原则,题目难度不大.


科目:高中化学 来源: 题型:选择题
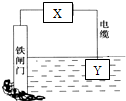
| A. | 若X为导线,Y可以是锌 | |
| B. | 若X为导线,铁闸门上的电极反应式为Fe-2e→Fe2+ | |
| C. | 若X为直流电源,铁闸门做负极 | |
| D. | 若X为直流电源,Y极上发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
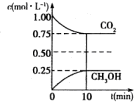 (1)二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放.在一定温度下的2L固定容积的密闭容器中,通入2molCO2和3molH2,发生的反应为CO2(g)+3H2(g) CH3OH(g)+H2O(g),△H=-aKJ•mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.
(1)二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放.在一定温度下的2L固定容积的密闭容器中,通入2molCO2和3molH2,发生的反应为CO2(g)+3H2(g) CH3OH(g)+H2O(g),△H=-aKJ•mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核外电子数为3 | B. | 相对原子质量为2 | ||
| C. | 原子结构示意图为  | D. | 原子结构示意图为  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
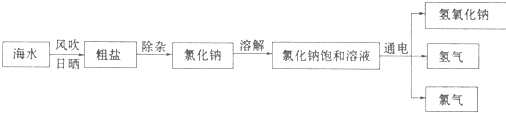
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2LCH4中含有的氢原子数为2NA | |
| B. | 标准状况下,0.3mol二氧化硫中含有氧原子数为0.3NA | |
| C. | 2.7g铝与足量的盐酸反应,失去的电子数为0.3NA | |
| D. | 0.1mol/L MgCl2溶液中含Mg2+数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将pH试纸直接放入某溶液中,测定该溶液的pH | |
| B. | 用澄清石灰水鉴别NaHCO3和Na2CO3 | |
| C. | 过滤操作时,漏斗下部的尖嘴要紧靠烧杯的内壁 | |
| D. | 从碘水提取碘可用乙醇作萃取剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
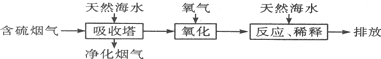
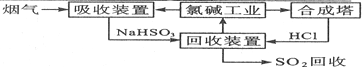
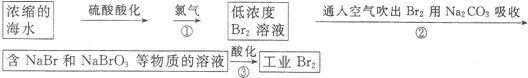
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com