
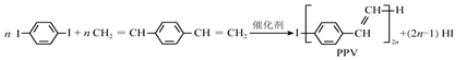
| A. | 合成PPV的反应为加聚反应 | |
| B. | PPV与聚苯乙烯具有相同的重复结构单元 | |
| C. | H2C═CH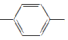 CH═CH2和苯乙烯互为同系物 CH═CH2和苯乙烯互为同系物 | |
| D. | 通过质谱法测定PPV的平均相对分子质量,可得其聚合度 |
分析 A.缩聚反应,是一类有机化学反应,是具有两个或两个以上官能团的单体,相互反应生成高分子化合物,同时产生有简单分子(如 H2O、HX、醇等)的化学反应;
B.聚苯乙烯的重复结构单元为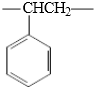 ,不含碳碳双键,而该高聚物的结构单元中含有碳碳双键;
,不含碳碳双键,而该高聚物的结构单元中含有碳碳双键;
C.同系物所含官能团数目相同;
D.质谱仪能记录分子离子、碎片离子的相对质量.
解答 解:A.合成PPV通过缩聚反应生成,同时有小分子物质HI生成,不属于加聚反应,故A错误;
B.聚苯乙烯的重复结构单元为 ,不含碳碳双键,而该高聚物的结构单元中含有碳碳双键,所以不相同,故B错误;
,不含碳碳双键,而该高聚物的结构单元中含有碳碳双键,所以不相同,故B错误;
C.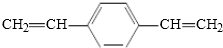 有两个碳碳双键,而苯乙烯有一个碳碳双键,结构不同,二者不是同系物,故C错误;
有两个碳碳双键,而苯乙烯有一个碳碳双键,结构不同,二者不是同系物,故C错误;
D.质谱仪能记录分子离子、碎片离子的相对质量,质谱图中数值最大的即是该分子的相对分子质量,故D正确.
故选D.
点评 本题主要考查有机物的结构和性质,侧重于学生的分析能力的考查,注意明确聚合反应原理,选项B为易错点,找准链节是解题的关键,难度不大.


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 molN2与4 mol H2在一定条件下反应生成NH3的分子数为2NA | |
| B. | 标准状况下,5.6LSO3中含有的原子总数为NA | |
| C. | 1 molCu和足量的硫粉加热反应转移的电子数是2NA | |
| D. | 常温下,4.6g NO2 和N2O4的混合物中氧原子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
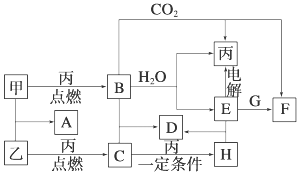
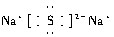 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
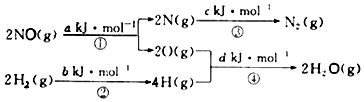
| A. | 0.5(a+b-c-d)kJ/mol | B. | 0.5(c+a-d-b)kJ/mol | ||
| C. | 0.5(c+d-a-b)kJ/mol | D. | 0.5(c+d-a-b)kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 文艺复兴时期,群青颜料曾用在许多著名的油画上,当时群青颜料是由贵重的青金石研磨并制成的.青金石是指碱性铝硅酸盐矿物,其中含钠、铝、硅、硫、氯、氧等元素.
文艺复兴时期,群青颜料曾用在许多著名的油画上,当时群青颜料是由贵重的青金石研磨并制成的.青金石是指碱性铝硅酸盐矿物,其中含钠、铝、硅、硫、氯、氧等元素. .
.| 化学式 | HClO4 | HClO3 | HClO2 | HClO |
| Ka | 1×1010 | 1×101 | 1×10-2 | 4×10-8 |
 ,HClO3中Cl原子的杂化轨道类型为sp3,HClO2中含有的共价键类型为σ键和π键.以上几种含氧酸的酸性强弱不同,其原因为几种含氧酸的酸性强弱不同,其原因为.
,HClO3中Cl原子的杂化轨道类型为sp3,HClO2中含有的共价键类型为σ键和π键.以上几种含氧酸的酸性强弱不同,其原因为几种含氧酸的酸性强弱不同,其原因为.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
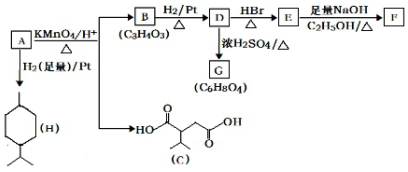
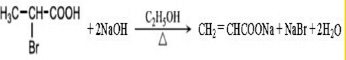
 $→_{△}^{KMnO_{4}/H+}$
$→_{△}^{KMnO_{4}/H+}$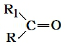 +R2COOH
+R2COOH .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁是生产生活中应用最广泛的金属,炼铁技术备受关注,已知:
铁是生产生活中应用最广泛的金属,炼铁技术备受关注,已知:| 编号 | 容器 | 起始时物质的量 mol | 平衡时物质的量/mol | 平衡常数(K) | |
| Fe2O3 | CO | Fe | |||
| 1 | 恒温 | 0.5 | 1.5 | 0.8 | K1 |
| 2 | 恒温 | 2 | 3 | m | K2 |
| 3 | 绝热 | 1 | 1.5 | n | K3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、NO3-、Cl- | B. | Na+、Fe2+、SO42-、NO3- | ||
| C. | Cu2+、Na+、SO42-、OH- | D. | Ba2+、SO32-、NO3-、K+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com