
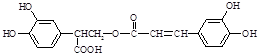
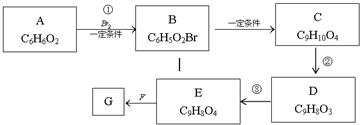
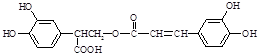 可知,A为
可知,A为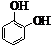 ;发生取代反应生成B为
;发生取代反应生成B为 ;根据B、C的分子式组成可知,B到C减少1个Br原子,多了3个C、5个H和2个O,结合G可知C只能含有1个侧链,可能为羧基,有可能为醛基,由于C到D脱去1分子水,则C中应该含有羟基,则C的结构简式为
;根据B、C的分子式组成可知,B到C减少1个Br原子,多了3个C、5个H和2个O,结合G可知C只能含有1个侧链,可能为羧基,有可能为醛基,由于C到D脱去1分子水,则C中应该含有羟基,则C的结构简式为 ,D的结构简式为
,D的结构简式为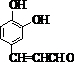 ;D转化成E只多了1个O原子,则为醛基氧化成羧基,所以E的结构简式为
;D转化成E只多了1个O原子,则为醛基氧化成羧基,所以E的结构简式为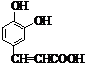 ;E与F生成G,则该反应为酯化反应,F的结构简式为:
;E与F生成G,则该反应为酯化反应,F的结构简式为: ,然后结合有机物的结构和性质以及题目要求可解答该题.
,然后结合有机物的结构和性质以及题目要求可解答该题.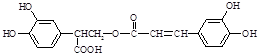 可知,A为
可知,A为 ;发生取代反应生成B为
;发生取代反应生成B为 ;根据B、C的分子式组成可知,B到C减少1个Br原子,多了3个C、5个H和2个O,结合G可知C只能含有1个侧链,可能为羧基,有可能为醛基,由于C到D脱去1分子水,则C中应该含有羟基,则C的结构简式为
;根据B、C的分子式组成可知,B到C减少1个Br原子,多了3个C、5个H和2个O,结合G可知C只能含有1个侧链,可能为羧基,有可能为醛基,由于C到D脱去1分子水,则C中应该含有羟基,则C的结构简式为 ,D的结构简式为
,D的结构简式为 ;D转化成E只多了1个O原子,则为醛基氧化成羧基,所以E的结构简式为
;D转化成E只多了1个O原子,则为醛基氧化成羧基,所以E的结构简式为 ;E与F生成G,则该反应为酯化反应,F的结构简式为:
;E与F生成G,则该反应为酯化反应,F的结构简式为: ,
, ;D的结构简式为:
;D的结构简式为: ,
, ;
; ;
; 与溴生成
与溴生成 ,属于取代反应;反应②为
,属于取代反应;反应②为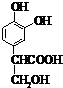 生成
生成 ,该反应巍峨消去反应,
,该反应巍峨消去反应, 中醛基被氧化成
中醛基被氧化成 中的羧基,需要弱氧化剂,如:新制氢氧化铜悬浊液或银氨溶液、稀盐酸,
中的羧基,需要弱氧化剂,如:新制氢氧化铜悬浊液或银氨溶液、稀盐酸,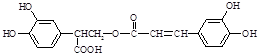 ,1molG中含有6mol可以被溴取代的苯环H和1mol碳碳双键,所以能够消耗7mol溴;1molG中含有4mol酚羟基、1mol羧基、1mol酯基,能够消耗6mol氢氧化钠,
,1molG中含有6mol可以被溴取代的苯环H和1mol碳碳双键,所以能够消耗7mol溴;1molG中含有4mol酚羟基、1mol羧基、1mol酯基,能够消耗6mol氢氧化钠, ,
, ;
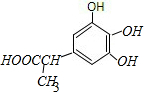
; ,与F互为同分异构体,且同时满足下列条件:①苯环上有四个取代基,且苯环上的一氯取代物只有一种,说明该有机物具有对称结构;②1mol该物质分别与NaHCO3、Na2CO3反应时,最多消耗NaHCO3、Na2CO3的量分别是1mol和4mol,该有机物中含有1个羧基、3个酚羟基,满足条件的有机物中含有侧链为:①3个酚羟基和1个-CH2CH2COOH、②3个酚羟基和1个-CH(CH3)COOH,①②分别组成满足条件的有机物的结构简式为:
,与F互为同分异构体,且同时满足下列条件:①苯环上有四个取代基,且苯环上的一氯取代物只有一种,说明该有机物具有对称结构;②1mol该物质分别与NaHCO3、Na2CO3反应时,最多消耗NaHCO3、Na2CO3的量分别是1mol和4mol,该有机物中含有1个羧基、3个酚羟基,满足条件的有机物中含有侧链为:①3个酚羟基和1个-CH2CH2COOH、②3个酚羟基和1个-CH(CH3)COOH,①②分别组成满足条件的有机物的结构简式为:

 、
、 、
、 ,总共有4种,
,总共有4种,

 英才计划期末调研系列答案
英才计划期末调研系列答案 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源: 题型:

| A、纳米Fe3O4分散在适当溶剂中,当强光照射时,会产生丁达尔现象 |
| B、反应①的反应类型为消去反应 |
| C、反应②中,环丙胺的作用可能是促进氯化铁水解 |
| D、反应③的化学方程式为:6FeOOH+CO═2Fe3 O4+3H2O+CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用分液漏斗分离乙醇和水 |
| B、用蒸馏的方法将自来水制成蒸馏水 |
| C、用加热的方法分离氯化钠和硝酸钾固体 |
| D、用四氯化碳萃取碘的饱和水溶液中的碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:
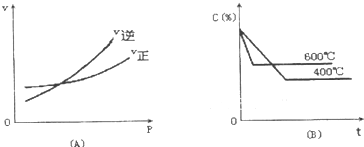 如图中C%表示某反应物在体系中的百分含量,v表示反应速率,P表示压强,t表示反应时间.下图(A)为温度一定时,压强与反应速率的关系曲线;下图(B)为压强一定时,在不同时间C%与温度的关系曲线.同时符合以下两个图象的反应是( )
如图中C%表示某反应物在体系中的百分含量,v表示反应速率,P表示压强,t表示反应时间.下图(A)为温度一定时,压强与反应速率的关系曲线;下图(B)为压强一定时,在不同时间C%与温度的关系曲线.同时符合以下两个图象的反应是( )| A、4NH2(g)+5O2(g)?4NO(g)+6H2O(g)△H=-808.7Kj/mol |
| B、N2O3(g)?NO2(g)+NO(g)△H=+41.8Kj/mol |
| C、3NO2(g)+H2O(l)?2HNO2(l)+NO(g)△H=-261.3Kj/mol |
| D、CO2(g)+C(s)?2CO(g)△H=+171.4Kj/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O4-) |
| B、NaHSO4 溶液:c(H+)=c(SO42-)+c(OH-) |
| C、pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中c(Cl-)>c(H+)>c(NH4+ )>c(OH-) |
| D、Na2S溶液:c(Na+ )=2c(HS-)+2c(S2-)>2c(H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 10.00 | 0.40 | 20.50 |
| 第二次 | 10.00 | 4.10 | 24.00 |
| 第三次 | 10.00 | 0.40 | 23.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com